
| 元素符号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
| A. | 14X可用与测定文物年代 | B. | Z的非金属性比T强 | ||
| C. | Y和T位于同一主族 | D. | X元素形成的化合物种类很多 |
分析 T的M层上的电子数是原子核外电子层数的2倍,应为S元素;X最外层电子数是次外层的2倍,因此X次外层为2个电子,最外层为4个电子,是C元素;Y单质是双原子分子,且其氢化物水溶液显碱性,可知Y是N元素;元素Z最高正价是+7价,因此Z是Cl,以此解答该题.
解答 解:A、14C可用与测定文物年代,故A正确;
B、同周期从左到右非金属性增强,所以Cl的非金属性比S强,故B正确;
C、N和S位于不同的主族,故C错误;
D、C是形成化合物种类最多的元素,故D正确;
故选C.
点评 此题主要考查了元素周期律以及原子核外电子排布知识,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意把握原子的结构特点.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
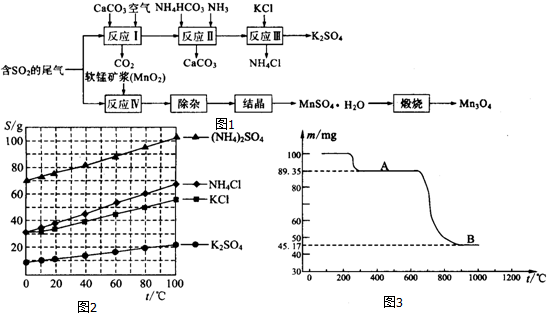
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为35的氯原子:${\;}_{35}^{17}$Cl | |
| B. | 14C的原子结构示意图: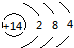 | |
| C. | N2分子的电子式: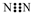 | |
| D. | 乙酸乙酯的结构简式为:CH3COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
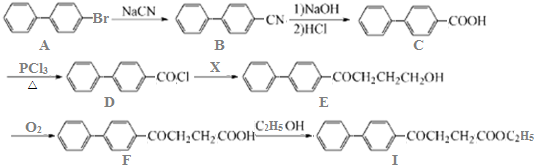
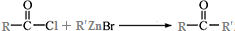
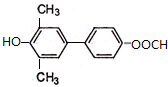 .
.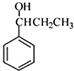 )为强效利胆药,请写出以甲苯和C2H5ZnBr为原料制备苯丙醇的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:
)为强效利胆药,请写出以甲苯和C2H5ZnBr为原料制备苯丙醇的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直线形;三角锥形 | B. | V形;三角锥形 | ||
| C. | 直线形;平面三角形 | D. | V形;平面三角形 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
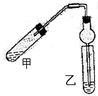 如图(铁架台、铁夹等省略)在试管甲中先加入碎瓷片,再加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸,用玻璃棒充分搅拌后将试管固定在铁架台上.在试管乙中加入5mL饱和碳酸钠溶液.按如图连接装置,用酒精灯对试管甲加热,当观察到试管乙中有明显现象时停止实验
如图(铁架台、铁夹等省略)在试管甲中先加入碎瓷片,再加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸,用玻璃棒充分搅拌后将试管固定在铁架台上.在试管乙中加入5mL饱和碳酸钠溶液.按如图连接装置,用酒精灯对试管甲加热,当观察到试管乙中有明显现象时停止实验查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com