
【题目】下列设计的实验方案能达到相应实验目的的是
选项 | 实验目的 | 实验方案 |
A | 探究化学反应的限度 | 取5mL0.1mol/LKI溶液,滴加0.1molLFeCl3溶液5~6滴,充分反应,可根据溶液中既含I2又含I-的实验事实判断该反应是可逆反应 |
B | 探究浓度对化学反应速率的影响 | 用两支试管各取5ml.0.1mo/L的KMnO4溶液,分别加入2mL0.1mol/L和10.2mol/L的H2C2O4(草酸)溶液,记录溶液褪色所需的时间 |
C | 证明海带中含有碘元素 | 将海带剪碎、加蒸馏水浸泡,取滤液加几滴稀硫酸和1mLH2O2,再加入几滴淀粉溶液,溶液变蓝 |
D | 验证CH3COONa 溶液中存在水解平衡 | 取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体(其水溶液呈中性),观察溶液颜色变化 |
A. A B. B C. C D. D
【答案】D
【解析】A、KI与FeCl3发生氧化还原反应,其离子反应为2Fe3++2I-=2Fe2++I2,因为KI是过量,因此溶液中存在I-和I2,不能说明反应是可逆反应,故A错误;B、酸性高锰酸钾溶液与草酸反应的离子方程式为:2MnO4-+5H2C2O4+6H+=8H2O+10CO2↑+2Mn2+,高锰酸钾过量,溶液不褪色,故B错误;C、海带剪碎,加蒸馏水,海带中I元素不能进入溶液中,应剪碎后点燃,然后加蒸馏水,过滤,故C错误;D、CH3COONa溶液中存在CH3COO-+H2O![]() CH3COOH+OH-,加入酚酞,溶液变红,加入醋酸铵固体,醋酸铵溶液呈中性,CH3COO-的浓度增大,平衡向正反应方向移动,颜色加深,故D正确。
CH3COOH+OH-,加入酚酞,溶液变红,加入醋酸铵固体,醋酸铵溶液呈中性,CH3COO-的浓度增大,平衡向正反应方向移动,颜色加深,故D正确。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列芳香族化合物之间的转化关系如下:
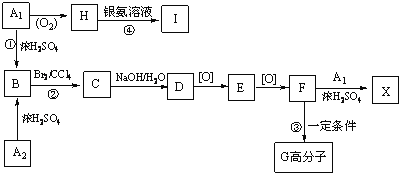
已知:A1和A2分别和浓H2SO4在一定温度下共热都只生成烃B,B的蒸气密度是同温同压下H2密度的59倍,B苯环上的一氯取代物有三种。
请结合上述信息回答:
(1)A2中所含官能团的名称为_______,B的结构简式为_________ ; G____________。反应C→D属于_______反应(填反应类型)。
(2)写出F→X反应的化学方程式_____________________________________;H→I反应的化学方程式____________________________________.
(3)化合物J是比化合物E多一个碳原子的E的同系物,化合物J有多种同分异构体,写出满足下列条件且核磁共振氢谱图中峰面积比为1:1:2:2:6的同分异构体的结构简式_______________任写一种即可)。
①苯环上有两个取代基 ②能使FeCl3溶液显色 ③与E含有相同官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿魏酸(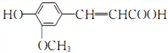 )能清除人体内的自由基,调节人体生理机能,某实验小组设计如下合成阿魏酸的路线(部分反应条件已略去):
)能清除人体内的自由基,调节人体生理机能,某实验小组设计如下合成阿魏酸的路线(部分反应条件已略去):

已知:①A能使氯化铁溶液显紫色,核磁共振氢谱有4组峰。
②两个羟基连在同一个碳原子上不稳定,易脱水形成羟基。
回答下列问题:
(1)A的名称为____________。
(2)由D生成E的反应类型为___________,由F生成G的反应类型为__________。
(3)写出B和NaOH溶液反应的化学方程式:________________________________。
(4)下列有关阿魏酸的说法中不正确的是_________。
a.阿魏酸分子中最多有10个碳原子共平面
b.阿魏酸能与乙醇在一定条件下发生取代反应
c.阿魏酸可清除体内有氧化性的自由基
d.阿魏酸能与酸性高锰酸钾溶液反应的官能团只有一种
(5)F的结构简式为_________。
(6)C的芳香族同分异构体有多种,写出两种能与NaOH溶液反应的同分异构体的结构简式:________________________________。
(7)利用![]() 制备
制备![]() ,请写出合成路线(其他无机试剂可任选)_________________________________________________________________________________。
,请写出合成路线(其他无机试剂可任选)_________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸H2A在水中的电离方程式是H2A = H+ + HA﹣,HA﹣![]() H+ + A2﹣.回答下列问题:
H+ + A2﹣.回答下列问题:
(1)Na2A溶液显______________(填“酸性”、“中性”或“碱性”),理由是________________________________(用离子方程式或必要的文字说明).
(2)常温下,已知0.1molL﹣1NaHA溶液pH=2,则0.1molL﹣1H2A溶液中氢离子的物质的量浓度可能______0.11molL﹣1(填“大于”、“等于”或“小于”),理由是_____________________.
(3)0.1molL﹣1NaHA溶液中各种离子浓度由大到小的顺序是_________.
(4)Na2A溶液中,下列表述正确的是_________.
A.c(Na+) + c(H+)= c(HA﹣)+ 2c(A2﹣)+ c(OH﹣)
B. c(OH﹣)= c(HA﹣)+ c(H+)
C.c(OH﹣)= c(HA﹣)+ c(H+)+ 2c(H2A)
D.c (Na+)= 2[c(HA﹣)+ c(A2﹣) + c(H2A)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氧化还原反应KClO3 + 6HCl = KCl + 3Cl2↑+ 3H2O中,当生成0.5 mol Cl2时,氧化产物和还原产物的物质的量之比为( )
A.5:1B.3:1C.1:3D.1:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是( )

A. 汉黄芩素的分子式为C16H13O5
B. 该物质中所有原子一定共面
C. 1 mol该物质与溴水反应,最多消耗2 mol Br2
D. 与足量H2发生加成反应后,该分子中官能团的种类减少1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Br2+2Fe2+===2Fe3++2Br-。向100mLFeBr2溶液中通入标况下氯气6.72L,氯气全部被还原,测得溶液c(Br-)=c(Cl-),原溶液中FeBr2溶液的浓度(mol·L-1)为( )
A. 2 B. 4 C. 2.5 D. 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一-选修3:物质结构与性质]由S、Cl 及Fe、Co、Ni 等过渡元素组成的新型材料有着广泛的用途,回答下列问题:
(1)钴元素基态原子的电子排布式为________,P、S、Cl的第一电离能由大到小顺序为______。
(2)SCl2 分子中的中心原子杂化轨道类型是______,该分子空间构型为_______。
(3)Fe、Co、Ni等过渡元素易与CO形成配合物,化学式遵循18电子规则:中心原子的价电子数加上配体提供的电子数之和等于18,如Ni 与CO形成配合物化学式为Ni(CO)4,则Fe与CO形成配合物化学式为_______。Ni(CO)4中σ键与π键个数比为_______,Ni(CO)4为____晶 体。
(4)已知NiO的晶体结构如图1所示。
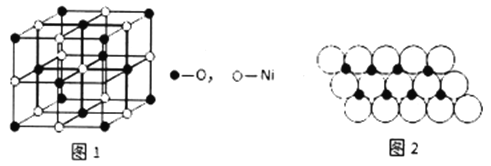
①NiO的晶体结构可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中。则NiO 晶体中镍原子填充在氧原子形成的______体空隙中。
②已知MgO 与NiO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66pm 和69pm。则熔点:MgO_____ NiO( 填“ >”、“ <" 或“ =” ), 理由是______________。
③一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充O2-形成的正三角形空隙中(如图2),已知O2-的半径为am,每平方米面积上分散的NiO的质量为_________g。(用a、NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相同时,反应中消耗的HCl和NaOH的物质的量之比为( )
A.3:1B.1:1C.2:1D.1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com