
| A. | KNO3的溶解度高于NaCl | |
| B. | KNO3的溶解度低于NaCl | |
| C. | 含有多种杂质时,KNO3比NaCl更适合利用降温结晶(或重结晶)法进行提纯 | |
| D. | 含有多种杂质时,NaCl比KNO3更适合利用降温结晶(或重结晶)法进行提纯 |
分析 溶解度与温度有关,且硝酸钾的溶解度受温度影响大,而NaCl的溶解度受温度影响不大,以此来解答.
解答 解:由KNO3和NaCl的溶解度曲线图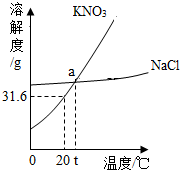 可知,
可知,
A.低温时KNO3的溶解度低于NaCl,故A错误;
B.温度较高时,KNO3的溶解度高于NaCl,故B错误;
C.硝酸钾的溶解度受温度影响大,而NaCl的溶解度受温度影响不大,则含有多种杂质时,KNO3比NaCl更适合利用降温结晶(或重结晶)法进行提纯,故C正确;
D.含有多种杂质时,NaCl比KNO3更适合利用蒸发结晶法进行提纯,故D错误;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握溶解度与温度的关系、溶解度的变化为解答的关键,侧重分析与应用能力的考查,注意结晶法的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | c=4 g+10 h | B. | c-b=2 d+3 f | C. | 2 d+3 f=3 g+8 h | D. | a+c=d+f |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg(OH)2不能转化为Ca(OH)2 | B. | Ca(OH)2的溶解度最小 | ||
| C. | Ca(OH)2不能转化为 Mg(OH)2 | D. | Ksp越大,S不一定越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶和分液漏斗使用前必须要检漏、干燥 | |
| B. | 可以用酒精萃取溶解在水中的碘 | |
| C. | 新制氯水应保存在棕色细口瓶中 | |
| D. | 某溶液焰色反应呈黄色,说明溶液中含有Na+,不含K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH(OH)CH2COOH系统命名法命名3-羟基丁酸 | |
| B. | 四苯基乙烯(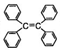 )中所有碳原子一定处于同一平面 )中所有碳原子一定处于同一平面 | |
| C. | lmol 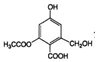 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别是3mol、4mol、1mol 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别是3mol、4mol、1mol | |
| D. | 在一定条件下,苯与液溴、浓硝酸生成溴苯、硝基苯的反应都属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | a | b |
| 试剂 | 0.1mol/L Fe(NO3)3 | 0.05mol/L Fe2(SO4)3 |
| 现象 | 银镜消失较快; 溶液黄色略变浅; 产生少许白色沉淀 | 银镜消失较慢; 溶液黄色明显变浅; 产生较多白色沉淀 |
| 实验方案 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com