
【题目】某同学做如图实验,以检验反应中的能量变化.
(1)实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是热反应;(b)中温度降低,由此可以判断(b)中反应是热反应.
(2)根据能量守恒定律,(b)中反应物的总能量应该其生成物的总能量.
 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】已知BaCO3和BaSO4均为难溶电解质,其溶度积分别为Ksp(BaCO3)=5.1×10﹣9mol2L﹣2 , Ksp(BaSO4)=1.1×10﹣10 mol2L﹣2 , 则下列说法中正确的是( )
A.BaSO4可做钡餐而BaCO3不能是因为Ksp(BaSO4)<Ksp(BaCO3)
B.在制腈纶纤维的1 L溶液中含SO ![]() 为1.0×10﹣3 mol,则加入0.01 mol BaCl2不能使SO
为1.0×10﹣3 mol,则加入0.01 mol BaCl2不能使SO ![]() 完全沉淀
完全沉淀
C.在清理有关仪器的BaSO4沉淀时,常加入饱和Na2CO3溶液,使BaSO4转化为BaCO3再用酸处理
D.用稀H2SO4洗涤BaSO4效果比用水好,BaCO3也能用此法处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验.可选用试剂:①KSCN溶液 ②NaOH溶液 ③酸性KMnO4溶液 ④K3[Fe(CN)6]溶液.
(1)请完成下表:
操作 | 现象 | 结论 |
取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | 存在Fe3+ | |
取少量除尽Ag+后的溶液于试管中,加入1~2滴(填序号)溶液,振荡 | 存在Fe2+ |
【实验结论】Fe的氧化产物为Fe2+和Fe3+
(2)Ⅱ.AgNO3的热稳定性用如图所示的实验装置A加热固体,产生红棕色气体,在装置D中收集到无色气体.当反应结束以后,试管中残留固体为黑色.
①装置B的作用是 .
②经小组讨论并验证该无色气体为O2 , 其操作方法是 .
③【查阅资料】①Ag2O和粉末的Ag均为黑色;②Ag2O可溶于氨水.
【提出假设】试管中残留的黑色固体可能是:①Ag;②Ag2O;③Ag和Ag2O.
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验:
实验编号 | 操 作 | 现 象 |
a | 加入足量氨水,振荡 | 黑色固体不溶解 |
b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验评价】根据上述实验,不能确定固体产物成分的实验是(填实验编号).
【实验结论】根据上述实验结果,得出AgNO3固体受热分解的化学方程式为
【实验拓展】另取2.0g AgNO3样品充分受热分解,共收集到标准状况下气体的体积为336mL,则样品中AgNO3的百分含量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在常温下发生水解时,对应的离子方程式正确的是( )
A.Na2CO3:CO ![]() +2H2O?H2O+CO2↑+2OH﹣
+2H2O?H2O+CO2↑+2OH﹣
B.NH4NO3:NH ![]() +H2O?NH3?H2O+H+
+H2O?NH3?H2O+H+
C.CuSO4:Cu2++2H2O?Cu(OH)2↓+2H+
D.KF:F﹣+H2O→HF+OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1200℃时,天然气脱硫工艺中会发生下列反应
H2S(g)+ ![]() O2(g)═SO2(g)+H2O(g)△H12H2S(g)+SO2(g)═
O2(g)═SO2(g)+H2O(g)△H12H2S(g)+SO2(g)═ ![]() S2(g)+2H2O(g)△H2
S2(g)+2H2O(g)△H2
2H2S(g)+O2(g)═2 S(g)+2H2O(g)△H32S(g)═S2(g)△H4
则△H4的正确表达式为( )
A.△H4= ![]() (3△H3﹣△H1)﹣△H2
(3△H3﹣△H1)﹣△H2
B.△H4= ![]() (△H1+△H2)+△H3
(△H1+△H2)+△H3
C.△H4= ![]() (△H1+△H2)﹣△H3
(△H1+△H2)﹣△H3
D.△H4= ![]() (△H1﹣△H2)﹣△H3
(△H1﹣△H2)﹣△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题
(1)镁原子的结构示意图_________________。
(2)氧化钠的电子式__________________。
(3)Si元素元素周期表中的位置在__________________________。
(4)在原子序数1~20号的元素中,最高价氧化物对应的水化物中碱性最强的是_____(用化学式表示)
(5)元素周期表中最高价氧化物对应水化物酸性最强的是________________(用化学式表示)
(6)短周期元素中,族序数为次外层电子数2倍的元素是_________________。(用元素符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,已知溶液中pH=﹣lg c(H+),KW=C(H+)C(OH﹣)=10﹣14 , KW是只与温度有关的常数,0.1mol/L的HA溶液中c(H+)=10﹣10 , 0.01mol/L的BOH溶液pH=12.请回答下列问题:
(1)HA是(填“强电解质”或“弱电解质”,下同),BOH是 .
(2)HA的电离方程式是 .
(3)在加水稀释HA的过程中,随着水量的增加而增大的是(填字母).
A.![]()
B.![]()
C.c(H+)与c(OH﹣)的乘积
D.c(OH﹣)
(4)常温下pH=12的BOH溶液100mL,加0.001mol/L NaHSO4 , 使溶液的pH为11.(混合溶液体积变化忽略不计),应加mL该浓度的 NaHSO4溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。

(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的硫酸为原料制取SO2,采用MnO2和浓盐酸(12 mol·L-1)为原料制取Cl2。在此实验中,F仪器的作用是________;发生装置B应选择以下三种装置中的________(填序号)。
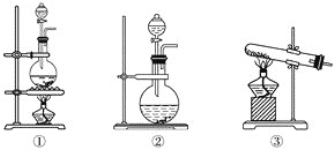
(2)D装置中主要反应的离子方程式为____________________________________________________。
(3)为验证通入D装置中的气体是Cl2过量还是SO2过量,兴趣小组的同学准备了以下试剂:
①氯化铁溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④酸性高锰酸钾溶液
若Cl2过量,取适量D中溶液滴加至盛有________(填一个序号,下同)试剂的试管内,再加入________试剂。发生的现象是_____________________________________________。
若SO2过量,取适量D中溶液滴加至盛有________试剂的试管内,发生的现象是________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com