

| A、a是阴极 |
| B、电解过程中溶液的浓度不变 |
| C、电解过程中b极质量减少 |
| D、阳极与阴极上的产物的物质的量之比为1:1 |


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:
| A、c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B、c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| C、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)═2HCl(g) |
| B、氢气与氯气反应生成2 mol氯化氢气体,反应吸收183 kJ的热量 |
| C、氢气与氯气反应生成1 mol氯化氢气体,反应放出183 kJ的热量 |
| D、氢气与氯气反应生成2 mol氯化氢气体,反应放出183 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
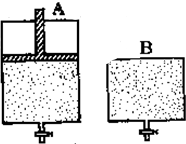 有两只密闭容器A和B.A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两个容器中分别充入等物质的量的体积比为2:1的SO2和O2的混合气体,并使A和B容积相等(如图所示).
有两只密闭容器A和B.A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两个容器中分别充入等物质的量的体积比为2:1的SO2和O2的混合气体,并使A和B容积相等(如图所示).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H1>△H2>△H3 |
| B、△H1<△H3<△H2 |
| C、△H1=△H3>△H2 |
| D、△H1>△H3>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当△H为“-”时,表示该反应为放热反应 | ||
B、已知C(s)+
| ||
| C、反应热的大小与反应物所具有的能量和生成物所具有的能量无关 | ||
| D、1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,放出的热量:CH3COOH<HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2+2FeCl2→2FeCl3 |
| B、Br2+2Fe2+→2Fe3++2Br- |
| C、2FeCl3+2KI→2FeCl2+2KCl+I2 |
| D、I2+2Fe2+→2I-+2Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁粉加入到FeCl3溶液中:Fe+Fe3+=2Fe2+ |
| B、过量的氨水滴加到氯化铝溶液:Al3++4OH-═AlO2-+2H2O |
| C、氯气与水反应:Cl2+H2O═Cl-+2H++ClO- |
| D、硅酸钠溶液中通入过量CO2:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com