
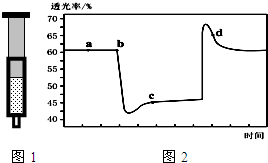
 已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,图1和图2是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,图1和图2是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )| A. | b点的操作是拉伸注射器 | |
| B. | d 点:v(正)<v(逆) | |
| C. | c点与a点相比,c(NO2)增大,c(N2O4)减小 | |
| D. | 若不忽略体系温度变化,且没有能量损失,则T(b)>T(c) |
分析 该反应是正反应气体体积减小的放热反应,压强增大平衡虽正向移动,但二氧化氮浓度增大,混合气体颜色变深,压强减小平衡逆向移动,但二氧化氮浓度减小,混合气体颜色变浅,据图分析,b点开始是压缩注射器的过程,气体颜色变深,透光率变小,c点后的拐点是拉伸注射器的过程,气体颜色变浅,透光率增大,据此分析.
解答 解:A、气体颜色变深,透光率变小,b点开始是压缩注射器的过程,故A错误;
B、c点后的拐点是拉伸注射器的过程,d点是平衡向气体体积增大的逆向移动过程,所以v(逆)>v(正),故B正确;
C、c点是压缩注射器后的情况,二氧化氮和四氧化二氮的浓度都增大,故C错误;
D、b点开始是压缩注射器的过程,平衡正向移动,反应放热,导致T(b)<T(c),故D错误;
故选B.
点评 本题通过图象和透光率考查了压强对平衡移动的影响,注意勒夏特列原理的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 阳离子 | NH4+、Na+、Mg2+ |
| 阴离子 | OH-、NO3-、SO42- |
| A. | 可能是Na2S04 | B. | 可能是NH4NO3 | C. | 可能是NaOH | D. | 一定不是(NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 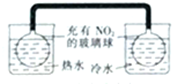 左边玻璃球内气体颜色更浅 | B. | 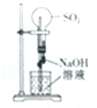 挤压胶头滴管产生喷泉现象 | ||
| C. | 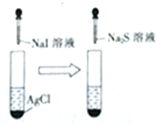 白色沉淀先变黄色再变黑色 | D. | 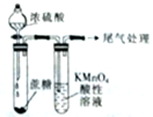 酸性高锰酸钾溶液褪色或变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
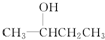 D.
D.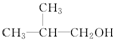 E.
E.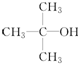
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
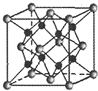 (1)X、Y、Z三种短周期元素,其中X的一种核素是最简单的原子,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子.
(1)X、Y、Z三种短周期元素,其中X的一种核素是最简单的原子,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下表是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:
下表是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com