
将铁棒与石墨棒用导线连接后浸入0.01 mol·L-1食盐溶液中,可能出现的现象是
A.铁棒附近产生OH- B.铁棒被腐蚀
C.石墨棒上放出Cl2 D.石墨棒上放出O2
科目:高中化学 来源:2014-2015福建省等四校高一上学期期中联考化学试卷(解析版) 题型:选择题
在无土裁培中,配制1L内含0.5mol NH4Cl、0.16mol KCl、0.24mol K2SO4的某营养液,若用KCl、NH4Cl和(NH4)2SO4三种固体配制,则需此三种固体的物质的量分别为
A.0.64mol 0.02mol 0.24mol B.0.66mol 0.50mol 0.24mol
C.0.64mol 0.50mol 0.24mol D.0.40mol 0.50mol 0.12mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海理工大学附中高三上学期月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.3mol NF3与水完全反应生成HF、HNO3和NO,转移电子数2NA
B.22.4L CO2与过量的Na2O2反应,转移的电子数为NA
C.60 g SiO2晶体中含有2 NA个Si-O键
D.常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三12月月考理综化学试卷(解析版) 题型:选择题
在盛有足量A的体积可变的密闭容器中,加入B,发生反应:A(s)+2B(g) 4C (s)+D(g),△H<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的B的物质的量的变化关系如图。
4C (s)+D(g),△H<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的B的物质的量的变化关系如图。
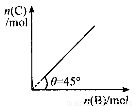
下列说法正确的是
A.平衡时B的转化率为50%
B.若再加入B,则再次达到平衡时正、逆反应速率均增大
C.若保持压强一定,再加入B,则反应体系气体密度减小
D.若保持压强一定,当温度升高10℃后,则图中θ>45?
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省等七校高三12月联考理综化学试卷(解析版) 题型:填空题
二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上以CO和H2为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
① CO(g) + 2H2(g) CH3OH(g) △H1=-Q1 kJ·mol-1
CH3OH(g) △H1=-Q1 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+ H2O(g) △H2=-Q2 kJ·mol-1
CH3OCH3(g)+ H2O(g) △H2=-Q2 kJ·mol-1
③ CO(g)+ H2O(g) CO2(g) + H2(g) △H3=-Q3 kJ·mol-1
CO2(g) + H2(g) △H3=-Q3 kJ·mol-1
回答下列问题:
(1)新工艺的总反应3H2(g)+ 3CO(g) CH3OCH3(g)+ CO2(g)的热化学方程式为_________。
CH3OCH3(g)+ CO2(g)的热化学方程式为_________。
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g) + 2H2(g) CH3OH (g) △H
CH3OH (g) △H
下表所列数据是该反应在不同温度下的化学平衡常数(Κ)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
① 由表中数据判断ΔH 0 (填“ >”、“=”或“<”)。能够说明某温度下该反应是平衡状态的是
A.体系的压强不变
B.密度不变
C.混合气体的相对分子质量不变
D.c(CO)=c(CH3OH)
② 某温度下,将 2mol CO和 6mol H2 充入2L的密闭容器中,充分反应 10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K= 。
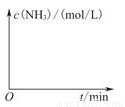
(3)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,在恒容密闭容器中冲入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,在恒容密闭容器中冲入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如下图。

请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为 。
②在实验Ⅲ中改变条件为采用比实验Ⅰ更高的温度,请在下图中画出实验I和实验Ⅲ中NH3浓度随时间变化的示意图。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴市高二10月月考化学试卷(解析版) 题型:计算题
某温度下,在装有催化剂的容积为2 L的反应容器中,充入SO2和O2各4 mol ,充分反应5 min后达到平衡,测得反应容器内混合气体的压强为原来的80 %。回答下列问题:
(1)用O2的浓度变化表示该反应的化学反应速率。
(2)求SO2的转化率。
(3)求该反应的平衡常数。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴市高二10月月考化学试卷(解析版) 题型:选择题
对某一可逆反应来说,使用催化剂的作用是
A.提高反应物的平衡转化率
B.以同样程度改变正逆反应的速率
C.增大正反应速率,减小逆反应速率
D.改变平衡混合物的组成
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴市高二10月月考化学试卷(解析版) 题型:选择题
已知:2C4H10(g)+13O2(g)===8CO2(g)+10H2O(l) ΔH=-5 800 kJ·mol-1 的叙述错误的是
A.该反应的反应热为ΔH=-5 800 kJ·mol-1,是放热反应
B.该反应的ΔH与各物质的状态有关,与化学计量数也有关
C.该式的含义为:25 ℃、101 kPa下,2 mol C4H10气体完全燃烧生成CO2 和液态水时放出热量5 800 kJ
D.该反应为丁烷燃烧的热化学方程式,则丁烷的燃烧热为5800 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊市高三上学期期中考试化学试卷(解析版) 题型:选择题
四种短周期元素在元素周期表中的相对位置如图所示,

其中丙元素最外层电子数是其电子层数的2倍。下列叙述正确的是
A.四种元素的单质中,丙单质的熔、沸点最高
B.丁元素氧化物对应水化物的酸性一定强于丙
C.乙元素形成的单核阴离子还原性强于丙
D.丁元素单质在化学反应中只表现氧化性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com