
| A. | HCl→CH3COONa溶液:c(Na+)>c(CH3COOH)=c(Cl-) | |
| B. | CO2→NH4HCO3溶液:c(NH4+)═c(HCO3-)+2c(CO32-) | |
| C. | SO2→NaOH溶液:c(Na+)═c(SO32-)+c(HSO3-)+c(H2SO3) | |
| D. | Cl2→NaOH溶液:2c(Cl-)═c(Na+)+c(HClO) |
分析 A.向0.10mol•L-1CH3COONa溶液中通入HCl,至溶液pH=7,反应后溶液中溶质为NaCl、醋酸和醋酸钠;
B.pH=7,则c(H+)=c(OH-),结合电荷守恒分析;
C.溶液中溶质可能是Na2SO3,也可能是NaHSO3,任何电解质溶液中都存在物料守恒,根据物料守恒判断;
D.发生的反应为Cl2+2NaOH═NaCl+NaClO+H2O,根据物料守恒判断.
解答 解:A.向0.10mol•L-1CH3COONa溶液中通入HCl,至溶液pH=7,c(H+)=c(OH-),HCl不足,反应后溶液中溶质为NaCl、醋酸和醋酸钠,由电荷守恒可知,c(Na+)=c(CH3COO-)+c(Cl-),由物料守恒可知,c(Na+)=c(CH3COOH)+c(CH3COO-),则c(Na+)>c(CH3COOH)=c(Cl-),故A正确;
B.pH=7,则c(H+)=c(OH-),结合电荷守恒可知,c(NH4+)=c(HCO3-)+2c(CO32-),故B正确;
C.如果溶质是Na2SO3,则存在:c(Na+)═2[c(SO32-)+c(HSO3-)+c(H2SO3)],如果溶质是:NaHSO3,则存在c(Na+)═c(SO32-)+c(HSO3-)+c(H2SO3),亚硫酸钠溶液呈碱性、亚硫酸氢钠溶液呈酸性,要使混合溶液呈中性,则溶液中溶质为亚硫酸钠、亚硫酸氢钠,则存在c(SO32-)+c(HSO3-)+c(H2SO3)<c(Na+)<2[c(SO32-)+c(HSO3-)+c(H2SO3)],故C错误;
D.发生的反应为Cl2+2NaOH═NaCl+NaClO+H2O,根据物料守恒得c(Cl-)═c(ClO-)+c(HClO)
,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(Na+)═c(Cl-)+c(ClO-),所以得2c(Cl-)═c(Na+)+c(HClO),故D正确;
故选C.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质成分及其性质是解本题关键,把握发生的反应、盐类水解及电离为解答的关键,注意pH=7的信息及应用,易错选项是C.


科目:高中化学 来源: 题型:选择题
| A. | CCl4可以由CH4制得,它可用于萃取碘水中的碘 | |
| B. | 相等的物质的量的乙烯和甲烷完全燃烧后产生的水的质量相同 | |
| C. | 用乙烯与HCl反应来制备氯乙烷比用乙烷与氯气反应更好 | |
| D. | 甲烷的空间构型是正四面体,所以二氯甲烷有两种不同的结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
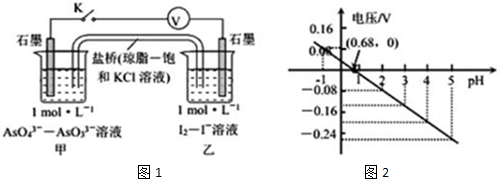
| A. | pH>0.68时,甲烧杯中石墨为负极 | |
| B. | pH=0.68时,反应处于平衡状态 | |
| C. | pH<0.68时,氧化性I2<AsO43- | |
| D. | pH=5时,负极电极反应式为2I--2e-=I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 有关信息 |
| X | 最外层电子数是次外层的2倍 |
| Y | 元素主要化合价为-2价 |
| Z | 其单质及化合物的焰色为黄色 |
| M | 与X同主族,其单质为半导体材料 |
| N | 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 |
 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红外光谱可确定分子内有O-H键、C-H键和C-O键 | |
| B. | 核磁共振氢谱有二个吸收峰 | |
| C. | 乙醇属于电解质 | |
| D. | 根据乙醇燃烧产物的种类可确定乙醇中含有碳、氢、氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量1mol•L-1的盐酸 | B. | 加入几滴CuSO4溶液 | ||
| C. | 加入少量NaNO3溶液 | D. | 加入少量CH3COONa溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com