
| A. | Z与X的最高价氧化物对应水化物反应可产生W的单质气体 | |
| B. | X、Y、Z三种元素的最高价氧化物对应水化物两两可发生反应 | |
| C. | Y的氧化物都可做呼吸面具的供氧剂 | |
| D. | W与X之间只能形成极性共价化合物 |
分析 W、X、Y、Z均为的短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,则W是H元素,X是N元素;Y、Z为第三周期元素;它们的最外层电子数之和为10,则Y、Z最外层电子数之和=10-1-5=4,由于Y、Z都位于第三周期,最外层电子数不可能都是2,Y最外层电子数为1时,Z的最外层含有3个电子,则Y为Na、Z为Al,据此进行解答.
解答 解:W、X、Y、Z均为的短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,则W是H元素,X是N元素;Y、Z为第三周期元素;它们的最外层电子数之和为10,则Y、Z最外层电子数之和=10-1-5=4,由于Y、Z都位于第三周期,最外层电子数不可能都是2,Y最外层电子数为1时,Z的最外层含有3个电子,则Y为Na、Z为Al,
A.X为N元素,其最高价氧化物对应水合物为硝酸,W的单质为氢气,Al与硝酸反应不会生成氢气,故A错误;
B.X、Y、Z三种元素分别为N、Na、Al,其最高价氧化物对应水化物分别为硝酸、氢氧化钠和氢氧化铝,三种物质之间两两可发生反应,故B正确;
C.Y为Na,其氧化物为氧化钠和过氧化钠,过氧化钠可做呼吸面具的供氧剂,而氧化钠与水、二氧化碳反应不会生成氧气,则不能做呼吸面具的供氧剂,故C错误;
D.W、X分别为H、N元素,二者可以形成离子化合物NH4H,电子式为 ,故D错误;
,故D错误;
故选B.
点评 本题考查了原子结构与元素周期律的关系及应用,题目难度不大,推断元素为解答关键,注意掌握元素周期律内容、元素周期表结构,D为易错点,注意N、H元素可以形成离子化合物.


科目:高中化学 来源: 题型:选择题
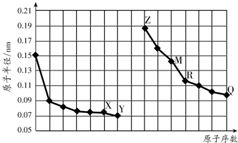
| A. | R在周期表的第15列 | |
| B. | 简单离子的半径:X>Z>M | |
| C. | Y、Q两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 | |
| D. | Z的单质能从M与Q元素构成的盐溶液中置换出单质M |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学式 | HCOOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-4 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰用于人工降雨 | |
| B. | 蔗糖中加入浓硫酸,蔗糖变黑,体积膨胀 | |
| C. | 溶洞中钟乳石的形成 | |
| D. | 豆科作物的根瘤菌对空气中氮的固定 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
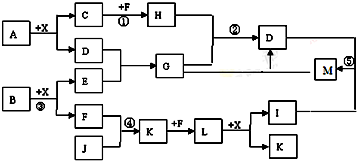
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
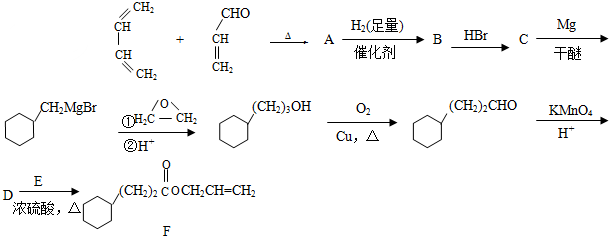
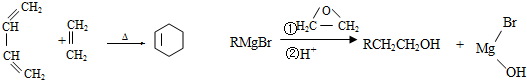
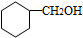 .
. .
. .
.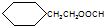
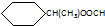 .
.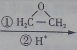 CH3CH2CH2CH2OH(其他试剂任选).
CH3CH2CH2CH2OH(其他试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:推断题
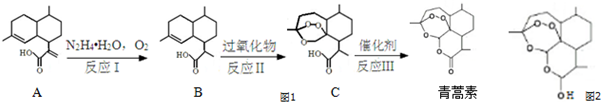
 为原料合成B,写出其合成路线(指明所用试剂和反应条件).
为原料合成B,写出其合成路线(指明所用试剂和反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
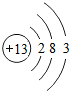 ,其最高价氧化物的水化物与氢氧化钠溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
,其最高价氧化物的水化物与氢氧化钠溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O. ,其中一种氢化物在常温下与MnO2混合的反应化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
,其中一种氢化物在常温下与MnO2混合的反应化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑. ,高温灼伤该化合物时,火焰呈黄色.
,高温灼伤该化合物时,火焰呈黄色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com