
| A、标准状况下,22.4L NO和22.4L O2的混合,混合气体中含有的氧原子数为3NA | ||||
| B、0.012kg 13C中,含中子数为7NA | ||||
| C、25℃时,1L pH=13的氢氧化钡溶液中含有0.1NA个氢氧根离子 | ||||
D、在反应3SiO2+6C+2N2
|
| m |
| M |
| N |
| NA |


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
 碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.请回答下列问题:
碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.请回答下列问题:| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,向20mL 0.1mol/L酒石酸(用H2T表示)溶液中逐滴滴加等物质的量浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系.下列说法正确的是( )
常温下,向20mL 0.1mol/L酒石酸(用H2T表示)溶液中逐滴滴加等物质的量浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系.下列说法正确的是( )| A、VNaOH=10mL时,溶液中存在[Na+]=2[H2T]+2[HT-]+2[T2-] |
| B、VNaOH=20mL时,溶液中存在[Na+]>[HT-]>[H+]>[H2T]>[T2-] |
| C、VNaOH=30mL时,溶液中存在[Na+]>[HT-]>[T2-]>[OH-]>[H+] |
| D、VNaOH=40mL时,溶液中存在[OH-]=[HT-]+2[H2T]+[H+] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、46g乙醇中含有的化学键数为7NA |
| B、1mol氯气和足量NaOH溶液反应转移电子数为2NA |
| C、1mol OH-和1mol-OH(羟基)中含有的质子数均为9NA |
| D、10L 0.1mol?L-1的Na2CO3溶液中,Na+、CO32-总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 |
| B、乙和甲中同种元素的质量分数相等,则乙能使湿润的KI淀粉试纸变蓝 |
| C、丙中含有ⅣA族元素,则相同条件下丙比甲稳定 |
| D、若丁的分子组成符合XY3型结构,则丁分子间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用如图所示装置进行实验,实验现象正确的是( )
用如图所示装置进行实验,实验现象正确的是( )| X | Y | Z | 实验现象 | |
| A | 苯酚浑浊液 | NaOH溶液 | 盐酸 | 浑浊液变澄清,后又变浑浊 |
| B | FeCl3溶液 | KSCN溶液 | 饱和KCl溶液 | 溶液变为红色,后颜色加深 |
| C | KI溶液 | 足量氯水 | 乙醇 | 溶液变为黄色,后溶液分层,上层为紫红色,下层为无色 |
| D | Na2SO3溶液 | Ba(NO3)2溶液 | 盐酸 | 生成白色沉淀,后沉淀溶解,有大量气体生成 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、NO3- | ||
B、常温下,
| ||
| C、滴入酚酞试液显红色的溶液:Mg2+、Al3+、Br-、SO42- | ||
| D、能溶解Al2O3的溶液:Na+、Ca2+、HCO3-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
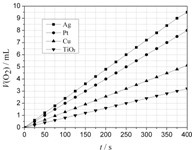 某些金属及金属氧化物对H2O2的分解反应具有催化作用,请回答下列问题:
某些金属及金属氧化物对H2O2的分解反应具有催化作用,请回答下列问题: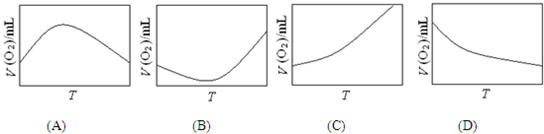
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com