
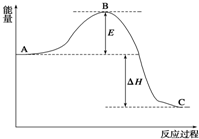
 2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图
2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图分析 (1)活化能的大小与反应热无关;使用催化剂降低活化能;
(2)根据参加反应SO2的物质的量之比等于对应的△H之比;
(3)速率之比等于对应物质的化学计量数之比,所以υ(O2)=$\frac{1}{2}$υ(SO2);
(4)1mol SO2(g)氧化为1mol SO3(g)是放热反应,而1mol SO3(g)还原为1mol SO2(g)是吸热反应;
(5)(2)单质硫的燃烧热为296KJ•mol-1,所以热化学方程式为:S(s)+O2(g)═SO2(g)△H=-296kJ/mol,利用盖斯定理解答该题.
解答 解:(1)反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,E的大小对该反应的反应热无影响;加V2O5催化剂会使图中B点降低,
故答案为:无;降低;
(2)因1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ•mol-1,则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ•mol-1,故答案为:-198;
(3)速率之比等于对应物质的化学计量数之比,所以υ(O2)=$\frac{1}{2}$υ(SO2)=0.025mol/(L•min),故答案为:0.025;
(4)1mol SO2(g)氧化为1mol SO3(g)是放热反应,而1mol SO3(g)还原为1mol SO2(g)是吸热反应,所以△H1<△H2,故答案为:<;
(5)因单质硫的燃烧热为296kJ•mol-1,则S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1,
而 1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,则SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-99kJ•mol-1,
由盖斯定律可得:S(s)+$\frac{3}{2}$O2(g)=SO3(g)△H=-296kJ•mol-1+(-99kJ•mol-1)=-395kJ•mol-1,
故答案为:S(s)+$\frac{3}{2}$O2(g)═SO3(g)△H=-395kJ•mol-1,所以S(s)生成3mol SO3(l)的反应热为:3×395kJ•mol-1=-1185 kJ/mol,故答案为:-1185 kJ/mol.
点评 本题综合考查反应热与焓变,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意催化剂对反应的影响以及反应热计算的应用,题目较简单.


 黄冈冠军课课练系列答案
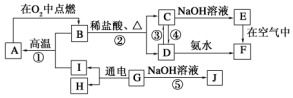
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
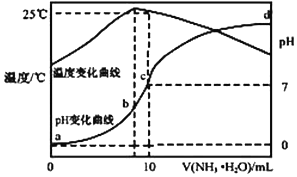 在某温度时,将 n mol•L-1氨水滴入 10mL 1.0mol•L-1 盐酸中,溶液 pH 和温度随加入氨 水体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将 n mol•L-1氨水滴入 10mL 1.0mol•L-1 盐酸中,溶液 pH 和温度随加入氨 水体积变化曲线如图所示,下列有关说法正确的是( )| A. | a 点 Kw=1.0×10-14 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | b 点:c(NH4+)>c(Cl-)>c(H +)>c(OH -) | |
| D. | 25℃时 NH4Cl 水解常数为(10n-1)×10-7mol•L-1(用 n 表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该有机物肯定是的含烃氧衍生物 | |
| B. | 该有机物能发生取代反应和加成反应 | |
| C. | 该有机物可能是C4H9Cl | |
| D. | 该有机物可能与CH3CH2OCH2CH2互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨工业是我省开磷集团的重要支柱产业之一.氨是一种重要的化工原料,在工农业生产中有广泛的应用.
合成氨工业是我省开磷集团的重要支柱产业之一.氨是一种重要的化工原料,在工农业生产中有广泛的应用.| 化学键 | N-H | N≡N | Br-Br | H-Br |
| 键能/kJ•mol-1 | 391 | 946 | 194 | 366 |
| 时间/min | CH4(mol) | H2O(mol) | CO (mol) | H2 (mol) |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | a | 0.80 | c | 0.60 |
| 7 | 0.20 | b | 0.20 | d |
| 10 | 0.21 | 0.81 | 0.19 | 0.64 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,100 g 46%乙醇水溶液中含有H原子数为12Na | |
| B. | 23g Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为Na | |
| C. | 标准状况下,2.24 L CC14含有的共价鍵数为0.4Na | |
| D. | l molN2与4molH2反应生成的NH3分子数小于2Na |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
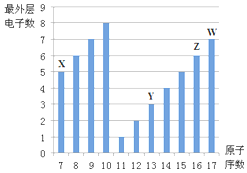 如图是部分短周期元素最外层电子数与原子序数的关系图.
如图是部分短周期元素最外层电子数与原子序数的关系图.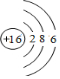 .
.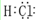 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | N≡N | H-O | N-H | O=O |
| E/(kJ/mol) | 946 | 463 | 391 | 496 |
| .01mol/L 的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com