
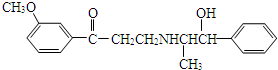
| A. | 该分子中含有酚羟基 | |
| B. | 该物质可以和浓氢溴酸发生取代反应 | |
| C. | 该物质可以和银氨溶液发生银镜反应 | |
| D. | 该分子苯环上的一氯取代物有6种 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
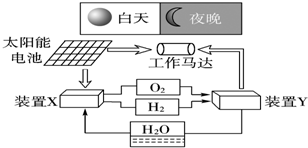
| A. | 二氧化硅是太阳能电池的光电转换材料 | |
| B. | 装置X能实现燃料电池的氢气和氧气再生 | |
| C. | 装置Y中负极的电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲乙两份混合物中均含Na2O20.16mol | |
| B. | 甲乙两份混合物中均含NaHCO30.02mol | |
| C. | 原混合物中Na2O2与NaHCO3物质的量之比无法确定 | |
| D. | 盐酸物质的量浓度可能为3.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | 实验结论 | 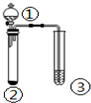 | |
| A | 盐酸 | Na2S | 硫酸铜溶液 | 稳定性:HCl>H2S | |
| B | 浓盐酸 | KMnO4 | KI-淀粉溶液 | 氧化性:KMnO4>Cl2>I2 | |
| C | 浓硫酸 | C | 澄清石灰水 | 浓硫酸具有强氧化性 | |
| D | 浓硝酸 | Cu | KI-淀粉溶液 | 氧化性:NO2>KI |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验①和②均能证明K2Cr2O7溶液中存在上述平衡 | |
| B. | 实验②能说明氧化性:Cr2O72->Fe3+ | |
| C. | CrO42-和Fe2+在酸性溶液中可以大量共存 | |
| D. | 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
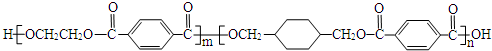
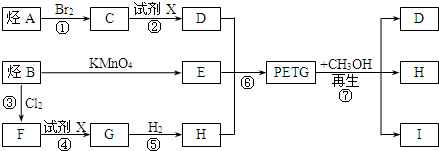
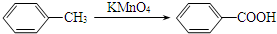
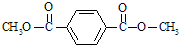 .
.
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂的氢化是指将不饱和程度较高、熔点较低的液态油,通过催化加氢,可提高饱和度,转化成半固态的脂肪的过程 | |
| B. | 在酸性条件下,蔗糖水解成葡萄糖和果糖,它们都能被溴水氧化 | |
| C. | 氨基酸是两性化合物,只有两个不同氨基酸分子间脱水才能形成肽键 | |
| D. | 蛋白质遇到醋酸铅变性沉淀,加入大量的水,沉淀还可溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
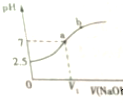
| A. | NaHSO3溶液呈酸性 | B. | V1<10mL | ||
| C. | 在a点,c(Na+)=c(SO32- )+c(HSO3-) | D. | 在b点,c(Na+)>c(SO3 2- ) |
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:简答题
已知A、B、C、D、E、F、G都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素。A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子,G的+1价阳离子正好充满K,L,M三个电子层。回答下列问题:
(1)A、B、C、D、E、F、G几种元素中第一电离能最小的是(填元素符号),D元素的原子核外有种不同运动状态的电子;有种不同能级的电子。基态的F3+核外电子排布式是。
(2)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物,原因是。
(3)化合物ECAB中的阴离子与AC2互为等电子体,该阴离子的电子式是。
(4)FD3与ECAB溶液混合,得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式是。
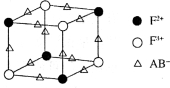
(5)化合物EF[F(AB)6]是一种蓝色晶体,右图表示其晶胞的1/8(E+未画出)。该蓝色晶体的一个晶胞中E+的个数为。
(6)G的二价阳离子能与乙二胺(H2N—CH2一CH2—NH2)形成配离子:
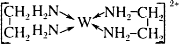
该配离子中含有的化学键类型有。(填字母)
a.配位键
B.极性键
C.离子键
D.非极性键
阴离子CAB-中的A原子与乙二胺(H2N—CH2一CH2—NH2)中C原子的杂化方式为。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com