
氢化亚铜(CuH)是一种不稳定物质,能在氯气中燃烧;也能与酸反应。用CuSO4溶液和“某物质”在40~50℃时反应可产生它。下列有关叙述中错误的是
| A.“某物质”具有还原性 |
| B.CuH与盐酸反应,可能产生H2 |
| C.CuH与足量的稀硝酸反应:CuH+ 3H++ NO3-→ Cu2++ NO↑+ 2H2O |
| D.CuH在氯气中燃烧:CuH+ Cl2→ CuCl+ HCl |
科目:高中化学 来源: 题型:单选题
某离子反应中涉及H2O、ClO—、NH4+、H+、N2、Cl—六种微粒。其中N2的物质的量随时间变化的曲线如图所示。下列判断正确的是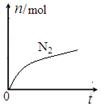
| A.该反应的还原剂是Cl— |
| B.消耗1 mol还原剂,转移6 mol电子 |
| C.氧化剂与还原剂的物质的量之比为2:3 |
| D.反应后溶液的酸性明显增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
NaClO2可用作造纸的漂白剂,它由H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2制得,下列说法正确的是
| A.H2O2是氧化剂,H2O2中的氧元素被还原 |
| B.每生成1 mol O2转移的电子的物质的量为4 mol |
| C.ClO2中的氯元素被氧化 |
| D.ClO2是氧化剂,H2O2是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将Cu、Cu2O和 CuO均匀混合物分成两等份,其中一份用足量的CO还原,测得反应后固体质量减少6.4g,另一份中加入150mL某浓度的硝酸,固体恰好完全溶解,且同时收集到标准状况下NOX气体6.72L,则所用硝酸的物质的量浓度可能为
| A.8.0mol·L-1 | B.9.0mol·L-1 | C.10.0mol·L-1 | D.11.0mol·L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定质量的镁、铝合金与硝酸溶液恰好完全反应,得硝酸盐溶液和NO2、N2O4、NO的混合气体,这些气体与标准状况下3.36L氧气混合后通入水中,所有气体恰好完全被水吸收生成硝酸。若向所得硝酸盐溶液中加入2mol/L NaOH溶液至沉淀最多时停止加入,将所产生沉淀滤出,向滤液加水稀释至500ml,此时所得溶液物质的量浓度为
| A.0.5mol/L | B.1mol/L | C.1.2mol/L | D.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某工厂利用FeCl3溶液腐蚀镀有铜的绝缘板生产电路板,一实验小组对该厂生产电路后所得的废液进行分析。取50.0 mL废液,向其中加入0.64 g Cu,金属铜全部溶解。另取50.0 mL废液,向其中加入足量的AgNO3,析出沉淀43.05 g,下列说法正确的是( )
| A.原废液中含有的金属阳离子只有Fe2+和Cu2+ |
| B.该工厂原来使用的FeCl3溶液的物质的量浓度约为2 mol/L |
| C.若向500 mL废液中加入足量的稀HNO3溶液,在标况下产生NO气体4.48 L,则原废液中Fe2+和Cu2+的物质的量浓度之比为2:1 |
| D.可以使用硫氰化钾溶液检验该废液中是否含有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com