
| A. | 任何化学反应都伴随着能量的变化 | |
| B. | 升高温度或加入催化剂,可以改变化学反应的反应热 | |
| C. | 化学反应中的能量变化都是以热量的形式体现 | |
| D. | 2CO(g)+O2(g)═2CO2(g)△H<0,则56g CO和32g O2所具有的总能量小于88g CO2所具有的总能量 |
分析 A.化学反应的实质是旧化学键的断裂和新化学键的形成;
B.使用催化剂只能改变反应速率,反应热和反应物以及生成物的能量有关;
C.能量变化可以是热能、电能、光能等;
D.放热反应中反应物的总能量大于生成物的总能量.
解答 解:A.化学反应的实质是旧化学键的断裂和新化学键的形成,旧键断裂吸收能量,新键形成要放出能量,所以任何化学反应都伴随着能量的变化,故A正确;
B.使用催化剂前后,反应物和生成物的能量是不变化的,化学反应的反应热是不变的,故B错误;
C.化学反应中一定伴随能量变化,能量变化可以是热能、电能、光能等,故C错误;
D.2CO(g)+O2(g)═2CO2(g)△H<0,该反应为放热反应,反应物的总能量大于生成物的总能量,则56g CO和32g O2所具有的总能量大于88g CO2,故D错误.
故选A.
点评 本题考查了化学反应的能量变化,题目涉及化学键与能量的关系、催化剂对反应的影响、能量转化形式等,题目难度不大,把握能量守恒和断裂化学键吸收能量,形成化学键放出能量是解题关键.


科目:高中化学 来源: 题型:实验题
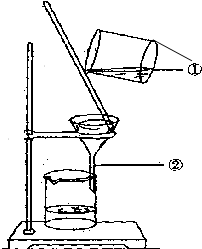 如图为某学生进行粗盐提纯实验中过滤操作的示意图,试回答:
如图为某学生进行粗盐提纯实验中过滤操作的示意图,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度能加快反应速率的主要原因,是增加了反应物分子中活化分子的百分数 | |
| B. | 正反应是吸热反应,达到平衡时,升高温度,v正增大,v逆减小,所以平衡向正反应方向移动 | |
| C. | 一定条件下增大反应物的量,一定会加快反应速率 | |
| D. | 对于任何一个化学反应,用其中任何一种反应物浓度的减小来表示化学反应速率,都是相同的数值 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 准确称取0.4000 g NaOH固体可配成100 mL 0.1000 mol•L-1的NaOH标准溶液 | |
| B. | 催化剂可以加快化学反应速率但不能改变化学反应的焓变 | |
| C. | 100 mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB酸性比HA弱 | |
| D. | 对于反应2SO2(g)+O2(g)?2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
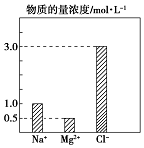 某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、H+、SO42-、CO32-.为了进一步确认,对该溶液进行实验检测:
某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、H+、SO42-、CO32-.为了进一步确认,对该溶液进行实验检测:| 实验操作与现象 | 实验结论 | 判断理由 | |
| 步骤一 | 仔细观察坐标图 | 肯定无 CO32- | 肯定无该离子的理由碳酸根离子和镁离子之间会反应 |
| 步骤二 | 该溶液呈无色、透明、均一状态 | 肯定无 Fe3+ | 肯定无该离子的理由该离子为黄色 |
| 步骤三 | 加入足量BaCl2溶液,生成23.3g白色沉淀,再加稀硝酸,沉淀不消失 | 肯定有SO42-、H+;肯定无Ba2+ | 肯定有H+的理由电荷守恒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外小组利用下列装置,对浓硫酸与乙醇反应的可能产物进行了如下探究.
某课外小组利用下列装置,对浓硫酸与乙醇反应的可能产物进行了如下探究.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com