
【化学选修3:物质结构与性质】(15分)
(1)目前,利用金属或合金储氢的研究已取得很大进展,如图是一种镍基合金储氢后的晶胞结构图。
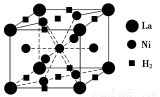
①Ni在元素周期表中的位置是 ,其基态原子的外围电子排布式 是 。
②该合金储氢后,含1 mol La的合金可吸收H2的物质的量为 。
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态的电子排布式可表示为 。
②BH—4的空间构型是 (用文字描述)。
(3)液氨是富氢物质,是氢能的理想载体,利用N2+3H2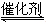 2NH3实现储氢和输氢。下列说法正确的是 (多项选择)。
2NH3实现储氢和输氢。下列说法正确的是 (多项选择)。
a.NH3分子中N原子采用sp3杂化
b.相同压强时,NH3沸点比PH3高
c.[Cu(NH3)4]2+离子中,N原子是配位原子
d.CN—的电子式为: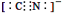
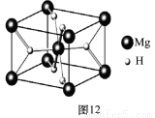
(4)MgH2是金属氢化物储氢材料,其晶胞结构如图12所示,已知该晶体的密度ag·cm-3,则晶胞的体积为 cm3〔用含a、NA的代数式表示(NA表示阿伏伽德罗常数)〕。
(15分)
(1)①第四周期 第Ⅷ族(2分) 3d84s2 (2分)
②3 mol(2分)
(2)①1s22 s22p63s23p63d2 或[Ar]3d2 (2分) ②正四面体 (2分)
(3)abcd (2分)
(4) 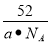 (3分)
(3分)
【解析】
试题分析:(1)①Ni在元素周期表中的位置是第四周期 第Ⅷ族;Ni的原子序数是28,所以外围电子的排布式是3d84s2 ;
②由晶胞结构图可知,La位于正方体的8个顶点,所以该晶胞中含有1个La,H2位于正方体的上下底面的中心以及上下底面棱的中点,所以该晶胞中含有H2的个数是2×1/2+8×1/4=3,所以含1 mol La的合金可吸收H2的物质的量为3mol;
(2)①Ti的原子序数是22,属于第IVB元素,Ti2+基态的电子排布式可表示为1s22 s22p63s23p63d2 或[Ar]3d2;
②BH—4的B的价层电子对数是4+1/2(3+1-4)=4,无孤对电子,所以空间构型是正四面体型;
(3)a、氨气分子中N原子的价层电子对数是4,所以N的杂化类型是sp3杂化,正确;b、氨气分子间存在氢键,所以氨气的沸点比PH3高,正确;c、[Cu(NH3)4]2+离子中,N原子提供孤对电子,所以N原子是配位原子,正确;d、CN-中C与N以三键结合,所以电子式为: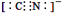 ;
;
(4)该晶胞中Mg原子的个数是8×1/8+1=2,则H原子的个数是4,所以设该晶胞的体积为V cm3,该晶胞的密度=(2×24+4×1)/NA/V=a,则V=52/aNA。
考点:考查原子的核外电子排布,在元素周期表中的位置的判断,晶胞的计算


科目:高中化学 来源:2015届北京市高三8月开学测试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.1 mol葡萄糖能水解生成2 mol CH3CH2OH和2 mol CO2
B.在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀
C.油脂不是高分子化合物,1 mol油脂完全水解生成1 mol甘油和3 mol高级脂肪酸
D.欲检验蔗糖水解产物是否具有还原性,可向水解后的溶液中直接加入新制的Cu(OH)2悬浊液并加热
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市元宝山区高二上学期期末化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A.化学反应过程中,一定有化学键的断裂和形成
B.盖斯定律实质上是能量守恒定律的体现
C.反应前后原子种类和数目不变遵循的是质量守恒定律
D.如果某化学反应的?H和?S均小于0,则反应一定能自发进行
查看答案和解析>>
科目:高中化学 来源:2015届云南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,则原氯化铝溶液和氢氧化钠溶液的物质的量浓度之比可能是( )
①1∶3 ②2∶3 ③1∶7 ④2∶7 ⑤任意比
A.⑤ B.只有① C.② ④ D.① ③
查看答案和解析>>
科目:高中化学 来源:2015届云南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式的是( )
A.足量的硫酸铝溶液与纯碱溶液反应: 2A13++3CO32-+3H2O =2A1(OH)3↓+3CO2↑
B. NaHS溶液的水解方程式: HS-+H2O H3O++S2-
H3O++S2-
C. Fe(OH)3与足量的HI溶液反应: Fe(OH)3+3H+=Fe3++3H2O
D.向亚硫酸氢铵溶液中加入足量的NaOH溶液: NH4++OH-=NH3·H2O
查看答案和解析>>
科目:高中化学 来源:2015届云南省云龙县高二下学期期末考试化学试卷(解析版) 题型:选择题
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应产物中SO2和NH3的物质的量之比为
A.1:4 B. 3:4 C. 4:1 D. 4:3
查看答案和解析>>
科目:高中化学 来源:2015届云南省云龙县高二下学期期末考试化学试卷(解析版) 题型:选择题
A是一种常见单质,B、C为常见化合物,A、B、C均含有元素X,它们有如下图的转化关系(部分产物及反应条件已略去)。下列判断正确的是
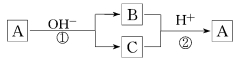
A.X元素可能为Al
B.X元素一定为金属元素
C.反应①和②一定互为可逆反应
D.反应①和②一定为氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时(人教选修4)4.4金属的电化学腐蚀与防护(解析版) 题型:选择题
下列叙述中正确的是( )
①锌跟稀硫酸反应制H2,加入少量硫酸铜溶液能加快反应速率;
②镀层破损后,白口铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀;
③电镀时,应把镀件置于电解槽的阴极;
④冶炼铝时,把氧化铝加入液态冰晶石中熔融后电解;
⑤钢铁表面常易锈蚀生成Fe2O3·nH2O。
A.①②③④⑤B.①③④⑤ C.①③⑤ D.②④
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第二章检测试卷(解析版) 题型:选择题
反应2SO2+O2 2SO3经一段时间后,SO3的浓度增加了0.8 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为( )
2SO3经一段时间后,SO3的浓度增加了0.8 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为( )
A.0.1 sB.2.5 sC.5 sD.10 s
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com