
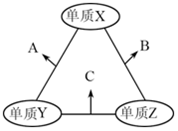
 X、Y、Z是原子序数依次增大的三种短周期元素,三种元素的原子序数之和为35,且Z的原子序数是X的原子序数的2倍.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,下列说法不正确的是( )
X、Y、Z是原子序数依次增大的三种短周期元素,三种元素的原子序数之和为35,且Z的原子序数是X的原子序数的2倍.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,下列说法不正确的是( )| A. | 元素X,Z的单质均存在同素异形体 | B. | A和C溶于水,溶液均显碱性 | ||
| C. | A和B都可能具有漂白性 | D. | Z的氧化物的水化物一定是强酸 |
分析 Z的原子序数是X的原子序数的2倍,如X为O,则Z为S元素,三种元素的原子序数之和为35,则Y为Na,由转化关系可知A为Na2O或Na2O2,B为SO2,C为Na2S,结合对应物质的性质解答该题.
解答 解:由以上分析可知X为O、Y为Na、Z为S,A为Na2O或Na2O2,B为SO2,C为Na2S,
A.X为O、Z为S,都存在多种同素异形体,如氧气、臭氧、斜方硫、单斜硫等,故A正确;
B.A为Na2O或Na2O2,与水反应生成氢氧化钠,Na2S为强碱弱酸盐,溶液都成碱性,故B正确;
C.A如为Na2O2,具有漂白性,B为SO2,也具有漂白性,故C正确;
D.Z为S,对应的氧化物如为SO2,则对应的酸为弱酸,故D错误.
故选D.
点评 本题考查无机物的推断,为高频考点,侧重考查学生的分析能力,注意把握原子的结构与元素周期律,把握物质的性质以及转化关系,难度不大.


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入过量氨水,有白色沉淀生成,则原溶液中一定有Al3+ | |
| B. | 加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则原溶液一定有SO42- | |
| C. | 向某溶液中先加入氯水振荡,再加KSCN溶液后显血红色,该溶液中一定有Fe2+ | |
| D. | 向某溶液中先加入新制饱和氯水,再加CCl4,振荡,分层,下层呈橙红色,则该溶液中一定含有Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| m | n | ||
| x | y |
 ,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.
,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室需要0.80mol•L-1 NaOH溶液475mL和0.40mol•L-1硫酸500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.80mol•L-1 NaOH溶液475mL和0.40mol•L-1硫酸500mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
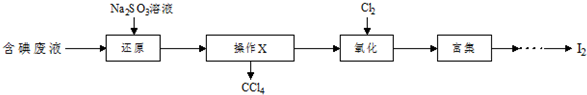
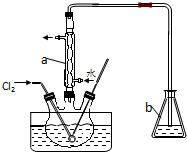
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com