
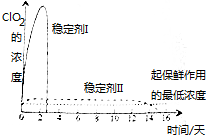
 目前,氯的氧化物有Cl2O、ClO2、Cl2O7等.其中ClO2与Cl2的氧化性质相近,在自来水消毒和果蔬保鲜等方面应用广泛.有关数据见下表:
目前,氯的氧化物有Cl2O、ClO2、Cl2O7等.其中ClO2与Cl2的氧化性质相近,在自来水消毒和果蔬保鲜等方面应用广泛.有关数据见下表:| 化学式 | Cl2O | ClO2 | Cl2O7 |
| 沸点/℃ | 3.8 | 11.0 | 82.0 |
分析 (1)常温下,沸点低于25℃的为气体;
(2)离子方程式为NCl3+6ClO2-+3H2O═6ClO2+3Cl-+3OH-+Y,结合电荷守恒可知Y为分子,再结合原子守恒分析;
(3)NaClO2在酸性条件下可发生反应生成NaCl并释放出ClO2,只有钠离子不参加反应;
(4)由图可知,稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度.
解答 解:(1)常温下,沸点低于25℃的为气体,则结合表格中的数据可知,Cl2O、ClO2为气体,故答案为:Cl2O、ClO2;
(2)离子方程式为NCl3+6ClO2-+3H2O═6ClO2+3Cl-+3OH-+Y,结合电荷守恒可知Y为分子,再结合原子守恒可知Y为NH3,故答案为:NH3;
(3)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据元素守恒可知应还有水生成,该反应的离子方程式为:4H++5ClO2-=Cl-+4ClO2↑+2H2O,
故答案为:4H++5ClO2-=Cl-+4ClO2↑+2H2O;
(4)由图可知,稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度,所以稳定剂Ⅱ好,
故答案为:稳定剂Ⅱ;稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应为解答关键为解答该题的关键,侧重分析与应用能力的考查,注意习题中信息及应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向CH3CH2Br中加入NaOH溶液共热,再向反应后的溶液中滴入AgNO3溶液以检验溴元素 | |
| B. | 利用红外光谱图,可以鉴别CH3OCH3和CH3CH2OH | |
| C. | 向甲酸和甲醛的混合物中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热,以检验混合物中是否含有甲醛 | |
| D. | 苯不能与溴水发生取代反应,用苯能萃取溴的四氯化碳溶液中的溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3和H2SO4 | B. | NaHSO4和Ba(OH)2 | C. | NaAlO2和H2SO4 | D. | AlCl3和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有一句正确 | B. | 有两句正确 | C. | 有三句正确 | D. | 四句均正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
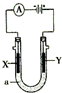 电解原理在化学工业中有广泛应用,如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.下列正确的是( )
电解原理在化学工业中有广泛应用,如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.下列正确的是( )| A. | 若X、Y为石墨,a为饱和NaCl溶液,向Y极附近加入酚酞,则Y极溶液呈红色 | |
| B. | 若X、Y是石墨,a为AgNO3溶液,电解一段时间后,溶液的pH减小 | |
| C. | 若用电解方法精炼粗铜,电解液a选用CuSO4溶液,X电极的材料是粗铜 | |
| D. | 若Y为铁,X为石墨,a为稀硫酸,Y电极反应为Fe-3e-=Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2FeO4在酸性溶液中不稳定,与水反应生成Fe3+和O2,离子方程式为:4FeO42-+10H2O+4Fe3+=20OH-+3O2↑ | |
| B. | 工业上可用FeCl3、NaOH、NaClO三种物质反应制得NaFeO4离子方程式为:2Fe3++10OH-+3ClO-=2FeO42-+3Cl-+5H2O | |
| C. | NaFeO4消毒杀菌时得到的Fe3+可以净水,Fe3+能产生净水物质的原因是:Fe3++3H2O?Fe(OH)3+3H+ | |
| D. | 工业上可用铁做阳极,电解浓NaOH溶液的方法制Na2FeO4,阳极的电极反应为:Fe-6e-+8OH-=FeO42-+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| B. | 水电离出的c(H+)=1×10-14mol•L-1的溶液中:Ba2+、NO3-、K+、SO32- | |
| C. | 使苯酚显紫色的溶液中:NH4+、Na+、Cl-、SCN- | |
| D. | 使甲基橙变红的溶液中:Na+、NH4+、SO42-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com