
【题目】如图装置中,容器甲内充入0.1 mol NO气体。干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体。恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积9/10,干燥管中物质的质量增加了2.24 g。随着CO2的继续通入,活塞又逐渐向右移动。下列说法中正确的是

A. 活塞从D处移动到C处的过程中,通入的CO2气体为2.24 L(标准状况)
B. NO2转化为N2O4的转化率为20%
C. 容器甲中NO已反应完
D. 活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处,则a小于0.01
【答案】D
【解析】
本题主要考查过氧化钠与二氧化碳反应,NO与氧气反应,2NO2![]() N2O4以及化学平衡的相关计算。CO2通入时,干燥管中发生反应:2Na2O2+2CO2===4NaOH+O2,C中发生反应:2NO+O2===2NO2
N2O4以及化学平衡的相关计算。CO2通入时,干燥管中发生反应:2Na2O2+2CO2===4NaOH+O2,C中发生反应:2NO+O2===2NO2![]() N2O4,导致气体体积减小。
N2O4,导致气体体积减小。
A.根据干燥管中固体物质的质量增加量计算通入的CO2体积;
B.根据O2计算出生成的NO2物质的量,再根据体积变化计算出转化的NO2物质的量,从而计算出转化率;
C.根据O2物质的量计算反应的NO;
D.因继续通入CO2时,体积不会缩小,即干燥管中Na2O2已反应完,活塞向右移动,2NO2![]() N2O4平衡向左移动,由此判断a值。
N2O4平衡向左移动,由此判断a值。
A.设通入标准状况下CO2气体的体积为x,产生氧气的体积为y,则:
2Na2O2+2CO2===2Na2CO3+O2 质量装置△m
2×22.4 L 22.4 L 56 g
x y 2.24 g
所以56 g:2.24g=2×22.4 L:x,解得x=1.792L,56 g:2.24g=22.4 L:y,解得:y=0.896L,即:通入二氧化碳的体积为1.792L,故A错误;
B.由A计算可知,生成氧气的物质的量:n(O2)=![]() =0.04mol,
=0.04mol,
2NO+O2===2NO2
2 1 2
0.08mol 0.04 mol0.08 mol
0.1 mol>0.08 mol,所以NO过量,生成NO2的物质的量为0.08 mol,
2NO2![]() N2O4 物质的量减少△n
N2O4 物质的量减少△n
2 1 1
0.02 mol 0.1 mol×(1-![]() )=0.01mol
)=0.01mol
所以NO2转化为N2O4的转化率为:![]() ×100%=25%,故B错误;
×100%=25%,故B错误;
C.根据B的计算可知,NO还剩余:0.1mol-0.08mol=0.02mol,故C错误;
D.活塞移至C,体积不会再减少,则干燥管中Na2O2已反应完,活塞由C向D移动,体积扩大,2NO2![]() N2O4平衡左移,使二者物质的量增多,活塞移至D时,气体物质的量共增加0.01 mol,因此所需CO2必小于0.01 mol,故D正确。
N2O4平衡左移,使二者物质的量增多,活塞移至D时,气体物质的量共增加0.01 mol,因此所需CO2必小于0.01 mol,故D正确。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)C在周期表中的位置____________________;
(2)由A、B、C三种元素形成的离子化合物的化学式为______________________。
(3)元素C、D、E形成的离子半径大小关系是___________________(用离子符号表示).
(4)用电子式表示化合物D2C的形成过程____________________________________。
C、D还可形成化合物D2C2,D2C2含有的化学键是_____________________________。其主要用途有______________________。
(5)现有空气中加热片刻生成的D的氧化物(假定全为D2C2和D2C的混合物)a克,与VLHCl反应至中性,则HCl的浓度取值范围为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 一定温度下,弱酸的电离常数越大,酸性越强
B. 醋酸的电离常数Ka和醋酸钠的水解常数Kh之间的关系为:Ka·Kh=Kw
C. 平衡常数只受温度影响,与反应物或生成物的浓度无关
D. 合成氨的反应,正反应的平衡常数和逆反应的平衡常数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:
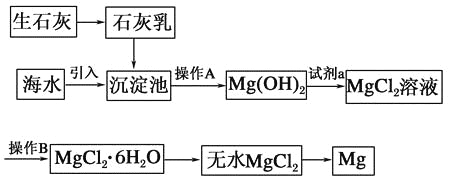
请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是________,写出在沉淀池中发生反应的离子方程式:_________________________________________________。
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度考虑,生产生石灰的主要原料来源于海洋中的________。
(3)操作A是________,操作B是________。
(4)加入的足量试剂a是________(填化学式)。
(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为________,从考虑成本和废物循环利用的角度,副产物氯气可以用于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中肯定错误的是( )
A. 某原子K层上只有一个电子
B. 某原子M层上电子数为L层上电子数的4倍
C. 某离子M层上和L层上的电子数均为K层的4倍
D. 某离子的核电荷数与最外层电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推理正确的是
A. 铝粉在氧气中燃烧生成Al2O3,铁丝在氧气中燃烧也生成Fe2O3
B. 铁能从硫酸铜溶液中置换出铜,钠也能从硫酸铜溶液中快速置换出铜
C. 铝片表面易形成致密的氧化膜,钠块表面也易形成致密的氧化膜
D. 钠与氧气、水等反应时钠均作还原剂,金属单质参与氧化还原反应时金属均作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)常温下,某水溶液M中存在的离子有Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式_________________________。
(2)若溶液M由10 mL 2 mol·L-1NaHA溶液与10 mL 2 mol·L-1 NaOH溶液等体积混合而成,则溶液M的pH________(填“<”“>”或“=”)7,溶液中离子浓度由大到小的顺序为______________。已知Ksp(BaA)=1.8×10-10,向该溶液中加入10 mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为________mol·L-1。
(3)若有下列三种溶液:①0.01 mol·L-1的H2A溶液;②0.01 mol·L-1的NaHA溶液;③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合,则三种情况下,溶液中c(H2A)最大的是____________;pH由大到小的顺序为______________。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液中![]() =104,V1与V2的大小关系为________(填“V1大于V2”“V1等于V2”“V1小于V2”或“均有可能”)。
=104,V1与V2的大小关系为________(填“V1大于V2”“V1等于V2”“V1小于V2”或“均有可能”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com