
【题目】常温下氢氧化锌在碱性溶液中的变化如图所示,横坐标为溶液的pH,纵坐标为Zn2+或ZnO![]() 的物质的量浓度的对数,下列说法正确的是( )
的物质的量浓度的对数,下列说法正确的是( )
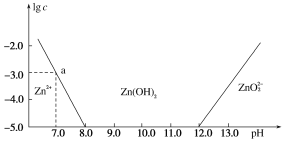
A. 依图中数据计算可得该温度下Zn(OH)2的溶度积(Ksp)=1×10-17
B. 溶液中加入足量氨水,发生反应的离子方程式为Zn2++4OH-===ZnO![]() +2H2O
+2H2O
C. 为提取工业废液中的Zn2+,可以控制溶液的pH在13左右
D. Zn2+在溶液中的存在形式与Al3+相似,碱性溶液中只以Zn(OH)2形式存在
【答案】A
【解析】
本题主要考查难溶电解质的溶解平衡及沉淀转化的本质;
A.Ksp=c(Zn2+)·c2(OH-);
B.氨水为弱电解质溶液,一水合氨部分电离不能拆成离子;
C.某废液中含Zn2+,为提取Zn2+,可形成沉淀过滤处理,先是开始沉淀,再是达到饱和溶液,但不能形成配离子再次溶解在溶液中,据此判断调控的pH范围;
D.向ZnCl2溶液中加入足量的氢氧化钠溶液,反应先产生Zn(OH)2沉淀,沉淀再生成ZnO22-的离子而溶解。
A.常温下,Zn2+离子浓度为10-5molL-1时,Zn2+离子已沉淀完全,溶液的pH=8.0,c(Zn2+)=10-5 molL-1,c(OH-)=10-6 molL-1,Ksp=c(Zn2+)c2(OH-)=10-5(10-6)2=10-17,故A正确;
B.离子方程式中一水合氨是弱电解质,不能拆成离子,锌离子和过量氨水反应生成锌氨络离子,Zn2++4NH3·H2O=[Zn(NH3)4]2++4H2O,故B错误;
C.某废液中含Zn2+,为提取Zn2+,可形成沉淀过滤处理,先是开始沉淀,再是达到饱和溶液,但不能形成配离子再次溶解在溶液中,根据图象,则可以控制pH的范围在8.0~12.0的范围内,溶液中锌离子浓度小于10-5 molL-1,可以近似认为锌离子不存在,故C错误;
D.向ZnCl2溶液中加入足量的氢氧化钠溶液,反应先产生Zn(OH)2沉淀,氢氧化钠过量后,沉淀溶解生成ZnO22-离子,反应过程的离子方程式可表示为:Zn2++2OH-═Zn(OH)2↓,Zn(OH)2+2OH=2H2O+ZnO22-,故D错误;


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极),下列说法正确的是( )
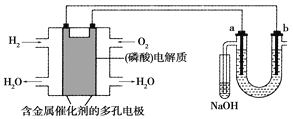
A. 电池工作时,正极反应式为O2+2H2O+4e-===4OH-
B. 电解时,电子流动路径是负极→外电路→阴极→溶液→阳极→正极
C. 试管中NaOH溶液用来吸收电解时产生的Cl2
D. 当电池中消耗2.24 L(标准状况下)H2时,b极周围会产生0.021 mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值减小,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值减小,可以采取的措施是
A. 通入少量HCl气体 B. 升高温度
C. 加少量醋酸钠晶体 D. 加水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.2mol·L-1HF溶液中加入1 L 0.2 mol·L-1CaCl2溶液,则下列说法中,正确的是 ( )
A. 25℃时,0.1 mol·L-1HF溶液中pH=1
B. 该体系中有CaF2沉淀产生
C. Ksp(CaF2)随温度和浓度的变化而变化
D. 加入CaCl2溶液后体系中的c(H+)浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.氯水、氨水、漂白粉都是混合物
B.C60、金刚石、石墨都是碳元素的同素异形体
C.HClO、H2SO4(浓)、HNO3都是强氧化性酸
D.Na2O2、Cl2、SO2都能使紫色石蕊溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)及其合金在冶金、农业、电气、化工、环保和宇航等重要领域有着广泛的应用和良好的前景,成为国民经济中一种重要的原料和不可替代的战略物质。钼酸钠晶体(Na2MoO4 ·2H2O)是一种重要的金属缓蚀剂。某工厂利用钼精矿(主要成分 MoS2 )制备钼酸钠晶体和金属钼的流程如图所示:

请回答下列问题:
(1)Na2 MoO 4·2H2O 中 Mo 的化合价是 ________。
(2)已知“焙烧”过程中 MoS2 变成 MoO3,则气体 1 中对大气有污染的是 ________。
(3)“碱浸”过程中生成 Na2MoO4 的化学方程式是 ________;“结晶”的钼酸钠晶体仍含其他杂质,要得到较纯的晶体,还应采取的方法是 ________。
(4)“滤液”的主要成分是 ________。
(5)将过滤操作得到的钼酸沉淀进行高温焙烧,实验室模拟高温焙烧时用于盛放钼酸的仪器是 ________。
(6)钼酸高温焙烧的产物与 Al 在高温下发生反应的化学方程式是 ________。
(7)测得碱浸液中部分离子浓度为:c(MoO42-) =0.4 mol·L-1,c(SO42-) =0.02 mol·L-1。结晶前加入氢氧化钡固体除去SO42-,不考虑加入氢氧化钡固体后溶液体积的变化,当BaMoO4开始沉淀时,SO42- 的去除率为 ________ (保留三位有效数字)。 [已知: Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通直流电用惰性电极电解,3个电解槽串联。
(1)第一个电解槽中盛放500 mL 1 mol/L AgNO3溶液,一段时间后溶液pH由6变为1,忽略电解前后溶液体积变化,试计算阴极上析出单质的质量_____________。
(2)另外2个电解槽盛放KCl,Al2O3的熔融态,计算该电解时间段阴阳极产物的物质的量_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.I.(1)常温下三种弱酸 HA、H2B、HC,电离平衡常数的数值为 1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:
① HA + HB- (少量)=A-+ H2B ,② H2B(少量) + C-=HB- + HC ,
③ HA(少量) + C-=A-+ HC 。则三种酸对应的电离平衡常数分别为(请填空)
HA | H2B | HC | ||
Ka | Ka1 | Ka2 | Ka3 | Ka4 |
数值 | ________ | ________ | ________ | ________ |
(2)常温下0.1 mol/L HA溶液加水稀释过程,下列表达式数据一定变小是_____。
A.c(A-) B.c(OH-) C.c(H+)c(OH-) D.c(OH-)/c(H+)
E.c(A-)/ c(H+) F. c(H+)/c(HA)
(3)某温度下,体积均为10 mL pH均为2 的HA溶液与HX溶液分别加水稀释至1000 mL,稀释后pH变化为:HA 3.2、HX 3.6,则该温度下HA电离平衡常数_____(填大于、等于或小于)HX,理由是_____;稀释过程中两溶液的c(OH-)将_____(变大、变小或不变)。
II.工业废水中常含有一定量的 Cr2O72- 和 CrO42-,它们会对人体及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法。
![]()
(4)转化过程中存在平衡 2CrO42- + 2H+![]() Cr2O72- + H2O,该转化过程中溶液颜色变化为_____,能说明反应到达平衡状态的是_____。
Cr2O72- + H2O,该转化过程中溶液颜色变化为_____,能说明反应到达平衡状态的是_____。
A.Cr2O72-和 CrO42-的浓度相同 B.ν正(Cr2O72-)=2 ν逆(CrO42-)
C.溶液的 pH 值保持不变 D.CrO42-不再转化为Cr2O72-
(5)若 1 L 转化后所得溶液中含铬元素质量为 28.6 g,CrO42-有 10/11 转化为Cr2O72-(已知铬元素相对原子质量为 52)。
① 转化后所得溶液中 c(Cr2O72-)=_____。
② 请写出该反应的平衡常数表达式 K=_________,已知:常温下该反应的平衡常数 K=1014,上述转化后所得溶液的 pH 为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com