
氢能源是一种重要的清洁能源。现有两种可产生H2的固体化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25 g/L。请回答下列问题:
(1)乙的电子式是__________。
(2)甲可在加热时将二氧化碳还原为甲烷,其化学方程式是 。
(3)乙在加热条件下与CuO反应可生成Cu和气体单质丙,写出该反应的化学方程式 。
(4)甲与乙之间能发生反应产生H2,判断理由是 。
(1)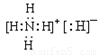
(2)4AlH3+3CO2 3CH4+2Al2O3
3CH4+2Al2O3
(3)2NH4H+5CuO 5Cu+
N2↑+5H2O
5Cu+
N2↑+5H2O
(4)AlH3中氢元素的化合价为-1价,NH4H中含有+1价的氢元素,二者可发生氧化还原反应产生H2。
【解析】
试题分析:“单质气体丙在标准状态下的密度为1.25 g/L”则丙的相对分子质量=1.25×22.4=28,所以丙为N2。化合物乙分解得到H2和N2,由于乙是固体,所以化合物乙为NH4H,NH4H由NH4+和H—构成的离子化合物。6.00 g化合物甲分解得到短周期元素的金属单质和6.72L÷22.4L/mol=0.3
molH2。根据质量守恒定律可知,该短周期元素的金属单质的质量为6.00g-0.2mol×2g/mol=5.40g;化合物甲与水反应生成的白色沉淀可溶于NaOH溶液,说明该沉淀可能是Al(OH)3,因此该金属元素是铝,所以可判定化合物甲为AlH3。涉及的反应为:a.甲、乙受热分解:2AlH3 2Al+3H2↑ 2NH4H
2Al+3H2↑ 2NH4H N2↑+5H2↑;b.甲与水反应: 2AlH3+6H2O==2Al(OH)3+6H2↑;c. 2NH4H+5CuO
N2↑+5H2↑;b.甲与水反应: 2AlH3+6H2O==2Al(OH)3+6H2↑;c. 2NH4H+5CuO 5Cu+
N2↑+5H2O。
5Cu+
N2↑+5H2O。
(1)化合物乙为NH4H,NH4H由NH4+和H—构成的离子化合物,其电子式为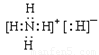 。
。
(2)AlH3可在加热时将二氧化碳还原为甲烷,则根据原子守恒可知,另外一种生成物应该是氧化铝,所以其化学方程式是4AlH3+3CO2 3CH4+2Al2O3。
3CH4+2Al2O3。
(3)NH4H在加热条件下与CuO反应可生成Cu和气体单质氮气,因此根据原子守恒可知,还有水生成,所以该反应的化学方程式 2NH4H+5CuO 5Cu+
N2↑+5H2O。
5Cu+
N2↑+5H2O。
(4)由于AlH3中氢元素的化合价为-1价,—1价H还原性很强,NH4H中含有+1价的氢元素,具有氧化性,所以二者可发生氧化还原反应产生H2。
考点:考查根据物质的性质及其计算进行推理,以及化学式、电子式、化学方程式的正确书写


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(浙江卷带解析) 题型:填空题
氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25 g/L。请回答下列问题:
(1)甲的化学式是_________;乙的电子式是__________。
(2)甲与水反应的化学方程式是__________________________________-。
(3)气体丙与金属镁反应的产物是_______(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式_________。
有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之_________________________。
(已知Cu2O+2H+=Cu+Cu2++H2O)
(5)甲与乙之间_______(填“可能”或“不可能)发生反应产生H2,判断理由是________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年黑龙江省佳木斯市高三第三次调研化学试卷(解析版) 题型:选择题
氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质丙和6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物M,该物质溶于氢氧化钠溶液。化合物乙是工业制取硝酸的原料之一,乙在催化剂存在下可分解得到H2和另一种单质气体丁。下列说法正确的是( )
A.工业上制备单质丙的方法是电解其氯化物
B.丙丁元素形成化合物可用于制作新型陶瓷
C.甲与水的反应中,水做还原剂
D.单质丙也可以与氢氧化钠反应,并生成白色沉淀物M
查看答案和解析>>
科目:高中化学 来源:2014届江西省红色六校高三第一次联考化学试卷(解析版) 题型:填空题
氢能源是一种重要的清洁能源。现有两种可产生 的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72
L的
的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72
L的 (已折算成标准状况)。甲与水反应也能产生
(已折算成标准状况)。甲与水反应也能产生 ,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到
,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到 和另一种单质气体丙,丙在标准状态下的密度为1.25g·L-1。请回答下列问题:
和另一种单质气体丙,丙在标准状态下的密度为1.25g·L-1。请回答下列问题:
(1)甲的化学式是_________;乙的空间构型是__________。
(2)甲与水反应的化学方程式是__________________________________。
(3)气体丙与金属镁反应的产物是_______(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式________ 有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之
_________________________。
(已知Cu2O+2H+==Cu+Cu2++H2O)
(5)甲与乙之间_______(填“可能”或“不可能)发生反应产生 ,判断理由是
,判断理由是
_______ _ 。
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(浙江卷解析版) 题型:填空题
氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25 g/L。请回答下列问题:
(1)甲的化学式是_________;乙的电子式是__________。
(2)甲与水反应的化学方程式是__________________________________-。
(3)气体丙与金属镁反应的产物是_______(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式_________。
有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之_________________________。
(已知Cu2O+2H+=Cu+Cu2++H2O)
(5)甲与乙之间_______(填“可能”或“不可能)发生反应产生H2,判断理由是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com