
A、金属被腐蚀的本质是:M+nH2O=M(OH)n+
| ||
| B、当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 | ||
| C、在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | ||
| D、可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 |
| B、液氨汽化时要吸收大量的热,可用作制冷剂 |
| C、生石灰能与水反应,可用来干燥氯气 |
| D、氯化铝是一种电解质,可用于电解法制铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
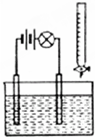 在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )| A、向盐酸中逐滴加入食盐溶液 |
| B、向硫酸溶液中逐滴加入氢氧化钠溶液 |
| C、向硫酸溶液中逐滴加入氢氧化钡溶液 |
| D、向醋酸溶液中逐滴加入氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5mol?L-1?min-1 |
| B、2.5mol?L-1?min-1 |
| C、2mol?L-1?min-1 |
| D、1.25mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钙和盐酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
| B、向氢氧化钡溶液中加硫酸溶液:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
| C、向稀盐酸溶液中加铁:2Fe+6H+═2Fe3++3H2↑ |
| D、向硝酸银溶液中加盐酸:Ag++C1-═AgCl↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com