
| A. | 淀粉、油脂、蛋白质都能水解,但水解产物不同 | |
| B. | 大豆富含蛋白质,故豆浆煮沸后蛋白质变成了氨基酸 | |
| C. | 石油的分馏、煤的气化、海水提溴的过程都包含化学变化 | |
| D. | 地淘油经处理后可作为汽车燃油,故地沟油的成分是液态烃 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
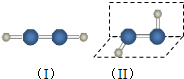 过氧化氢是应用广泛的“绿色”氧化剂,酸性条件下稳定,中性或弱碱性条件下易分解.填空:
过氧化氢是应用广泛的“绿色”氧化剂,酸性条件下稳定,中性或弱碱性条件下易分解.填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 操作及现象 |
| ⅰ | 取少量固体样品,加入过量稀盐酸,固体溶解,产生无色气体(经检验为H2),溶液呈浅黄色 |
| ⅱ | 向ⅰ中所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
| 实验序号 | 操作、现象 |
| ⅲ | 将ⅱ中剩余溶液均分为两份,一份滴加NaOH溶液,产生红褐色沉淀; 另一份滴加BaCl2溶液,产生白色沉淀,加入盐酸,沉淀不溶解 |
| ⅳ | 取2mL 0.1mol/L FeCl3溶液,滴入KSCN溶液,溶液变为红色,通入一段时间O2, 无明显变化.再加入H2O2溶液,红色很快褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
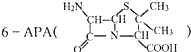 是青霉素类抗生素的母核,与有机物F缩合生成阿莫西林.某同学用对甲基苯酚为原料设计阿莫西林的合成路线如图:
是青霉素类抗生素的母核,与有机物F缩合生成阿莫西林.某同学用对甲基苯酚为原料设计阿莫西林的合成路线如图: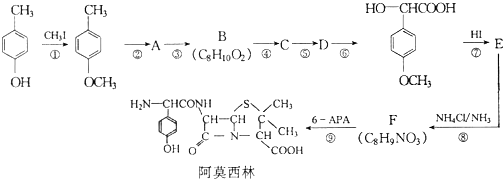
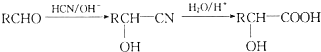
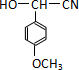 .
.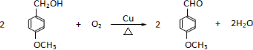 .
.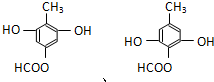 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
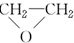 (环氧乙烷).
(环氧乙烷).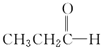 $\stackrel{NaBH_{4}}{→}$CH3CH2CH2OH
$\stackrel{NaBH_{4}}{→}$CH3CH2CH2OH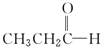 $→_{HCl}^{Zn(Hg)}$CH3CH2CH3
$→_{HCl}^{Zn(Hg)}$CH3CH2CH3查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①和② | B. | 只有②③④ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
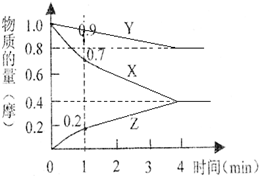 某温度时,2L的密闭容器中X、Y、Z三种物质的物质的量随时间的变化如下图所示.
某温度时,2L的密闭容器中X、Y、Z三种物质的物质的量随时间的变化如下图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com