
【题目】MnO2是一种重要的无机功能材料,工业上从锰结核中制取纯净的MnO2工艺流程如图所示: 
部分难溶的电解质溶度积常数(Ksp)如下表:
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10﹣17 | 10﹣17 | 10﹣39 |
已知:一定条件下,MnO4﹣可与Mn2+反应生成MnO2
(1)步骤Ⅱ中消耗0.5molMn2+时,用去1molL﹣1的NaClO3溶液200ml,该反应离子方程式为 .
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是 .
(3)MnO2是碱性锌锰电池的正极材料.放电过程产生MnOOH,该电池正极的电极反应式是 . 如果维持电流强度为5A,电池工作五分钟,理论消耗锌g.(已知F=96500C/mol)
(4)向废旧锌锰电池内的混合物(主要成分MnOOH、Zn(OH)2)中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,写出MnOOH参与反应的离子方程式 . 向所得溶液中滴加高锰酸钾溶液产生黑色沉淀,设计实验证明黑色沉淀成分为MnO2
(5)用废电池的锌皮制作ZnSO47H2O的过程中,需除去锌皮中的少量杂质铁,其方法是:加入稀H2SO4和H2O2 , 铁溶解变为Fe3+ , 加碱调节pH为时,铁刚好沉淀完全(离子浓度小于1×10﹣5molL﹣1时,即可认为该离子沉淀完全).继续加碱调节pH为时,锌开始沉淀(假定Zn2+浓度为0.1molL﹣1).若上述过程不加H2O2 , 其后果和原因是
【答案】
(1)5Mn2++2ClO3﹣+4H2O=5MnO2+Cl2↑+8H+
(2)氯酸钠
(3)MnO2+H2O+e﹣═MnOOH+OH﹣;0.5
(4)2MnOOH+H2C2O4+2H2SO4=2CO2↑+2MnSO4+4H2O;取少量黑色固体放入试管中,加入少量浓盐酸并加热,产生黄绿色气体,说明黑色固体为MnO2
(5)2.7;6;Zn(OH)2、Fe(OH)2的Ksp相近,Zn2+和Fe2+分离不开
【解析】解:工业上从锰结核中制取纯净的MnO2工艺流程中,先选矿富集,锰结核为锰的氧化物与其它金属氧化物的混合物,加入稀硫酸和试剂甲发生反应生成Mn2+ , 说明发生了氧化还原反应生成锰离子,则甲为还原剂,在溶液中加入NaClO3反应生成MnO2、水和气体A等,A和热氢氧化钠溶液反应生成溶液B,溶液B中的产物之一(Q)可循环用于上述生产证明Q为NaClO3 , 则A为Cl2 , B为氯化钠、氯酸钠的溶液,二氧化锰不溶于水,得到MnO2 . (1)0.1mol/L的NaClO3溶液200ml的物质的量是0.02mol,当生成0.05molMnO2时,转移电子的物质的量是0.05mol×(4﹣2)=0.1mol,根据电子得失守恒可知0.02mol氯酸钠得到0.1mol电子,因此氯元素的化合价变化5价,即从+5价降低到0价,因此还原产物是氯气,所以该反应离子方程式为2ClO3﹣+5Mn2++4H2O=5MnO2+8H++Cl2↑,所以答案是:2ClO3﹣+5Mn2++4H2O=5MnO2+8H++Cl2↑;(2)氯气与热的氢氧化钠溶液反应生成氯酸钠、氯化钠和水,因此可以循环的物质B是氯酸钠,
所以答案是:氯酸钠;(3)原电池中负极失去电子,正极得到电子,因此碱性锌锰电池放电时,正极是二氧化锰得到电子,则电极反应式为:MnO2+H2O+e﹣=MnO(OH)+OH﹣;5分钟转移电子的电量Q=It=5A×300s=1500C,转移电子的物质的量为 ![]() =
= ![]() ≈0.0155mol,则消耗的Zn的质量为
≈0.0155mol,则消耗的Zn的质量为 ![]() ×65g/mol=0.5g;所以答案是:MnO2+H2O+e﹣═MnOOH+OH﹣;0.5g;(4)因为反应物有稀草酸,产物有二氧化碳,则说明碳元素化合价升高发生氧化还原反应,所以锰化合价降低生成二价的MnSO4 , 方程式为2MnOOH+H2C2O4+2H2SO4=2CO2↑+2MnSO4+4H2O;根据实验室制氯气的反应原理,取少量黑色固体放入试管中,加入少量浓盐酸并加热,产生黄绿色气体,说明黑色固体为MnO2;所以答案是:2MnOOH+H2C2O4+2H2SO4=2CO2↑+2MnSO4+4H2O;取少量黑色固体放入试管中,加入少量浓盐酸并加热,产生黄绿色气体,说明黑色固体为MnO2;(5)铁加入稀H2SO4和H2O2 , 可被氧化生成Fe3+ , 铁刚好沉淀完全时离子浓度小于1×10﹣5molL﹣1 , 因Ksp=10﹣39 ,
×65g/mol=0.5g;所以答案是:MnO2+H2O+e﹣═MnOOH+OH﹣;0.5g;(4)因为反应物有稀草酸,产物有二氧化碳,则说明碳元素化合价升高发生氧化还原反应,所以锰化合价降低生成二价的MnSO4 , 方程式为2MnOOH+H2C2O4+2H2SO4=2CO2↑+2MnSO4+4H2O;根据实验室制氯气的反应原理,取少量黑色固体放入试管中,加入少量浓盐酸并加热,产生黄绿色气体,说明黑色固体为MnO2;所以答案是:2MnOOH+H2C2O4+2H2SO4=2CO2↑+2MnSO4+4H2O;取少量黑色固体放入试管中,加入少量浓盐酸并加热,产生黄绿色气体,说明黑色固体为MnO2;(5)铁加入稀H2SO4和H2O2 , 可被氧化生成Fe3+ , 铁刚好沉淀完全时离子浓度小于1×10﹣5molL﹣1 , 因Ksp=10﹣39 ,
则c(OH﹣)= ![]() mol/L≈0.5×10﹣11mol/L,此时pH=2.7,
mol/L≈0.5×10﹣11mol/L,此时pH=2.7,
如锌开始沉淀,则c(OH﹣)= ![]() mol/L=10﹣8mol/L,此时pH=6,
mol/L=10﹣8mol/L,此时pH=6,
由表中数据可知Zn(OH)2、Fe(OH)2的Ksp相近,如不加H2O2 , 则Zn2+和Fe2+分离不开,
所以答案是:Fe3+;2.7;6;Zn(OH)2、Fe(OH)2的Ksp相近,Zn2+和Fe2+分离不开.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl﹣个数为NA
B.常温常压下,1.06gNa2CO3含有的Na+数为0.02NA
C.通常状况下,NA个CO2分子占有的体积为22.4L
D.标准状况下,22.4LH2O含有的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代传感信息技术在化学实验中有广泛的应用.某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(如图1所示),并测定电离平衡常数Kb. 
(1)实验室可用浓氨水和X固体制取NH3 , X固体可以是
A.生石灰
B.无水氯化钙
C.五氧化二磷
D.碱石灰
(2)检验三颈瓶集满NH3的方法是 .
(3)关闭a,将带有装满水的胶头滴管的橡皮塞塞紧c口, , 引发喷泉实验,电脑绘制三颈瓶内气压变化曲线如图2所示.图2中点时喷泉最剧烈.
(4)从三颈瓶中用(填仪器名称)量取20.00mL氨水至锥形瓶中,用0.05000mol/L HC1滴定.用pH计采集数据、电脑绘制滴定曲线如图3所示.
(5)据图3计算,当pH=11.0时,NH3H2O电离平衡常数Kb近似值,Kb .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 常温时硅化学性质不活泼,不能与任何物质反应
B. 晶体硅具有金属光泽,可以导电,属于金属材料
C. Na2SiO3是制备硅胶和木材防火剂的原料
D. 二氧化硅是将太阳能转化为电能的常用材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池是一种新型的绿色环保储能电池.其电池总反应为:
V3++VO2++H2O ![]() VO2++2H++V2+ , 下列说法正确的是( )
VO2++2H++V2+ , 下列说法正确的是( )
A.放电时每转移2mol电子时,消耗1mol氧化剂
B.放电时正极反应为:VO+2+2H++e﹣=VO2++H2O
C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极
D.充电过程中,H+由阴极区移向阳极区迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于甲烷与氯气反应的叙述有
①常温下,产物一氯甲烷是气体,其他3种氯代产物都是液体;
②二氯甲烷只有一种的事实证明了甲烷不是平面正方形;
③实验室可以通过排饱和食盐水的方法收集甲烷和氯气;
④如果把收集好甲烷和氯气的试管放在日光直射的地方,可能会发生爆炸;
⑤光照时,试管中甲烷和氯气的混合气体的颜色逐渐变浅,试管壁出现油状液滴,试管中有少量白雾。其中正确的是
A. ①②③④⑤B. ①②③C. ②③④D. ①②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素X最高价含氧酸的相对分子质量为98,且X的氢化物的分子式不是H2X,则下列说法正确的是
A. X的最高价含氧酸的分子式可表示为H3XO4
B. X是第二周期ⅤA族元素
C. X是第三周期ⅥA族元素
D. X的最高正化合价为+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)浓硫酸与木炭粉在加热条件下反应的化学方程式是: .
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物. 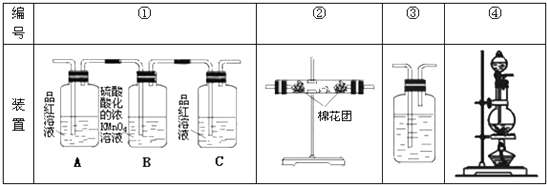
这些装置的连接顺序(按产物气流从左至右的方向)是(填装置的编号):→→→
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色.A瓶溶液的作用是 , B瓶溶液的作用是 , C瓶溶液的作用是 .
(4)装置②中所加固体药品是 , 可验证的产物是 , 确定装置②在整套装置中位置的理由是 .
(5)装置③中所盛溶液是 , 可验证的产物是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( ) 
A.该硫酸与等质量的水混合后所得溶液的浓度大于9.2 mol/L
B.1 mol Mg与足量该硫酸反应产生2 g氢气
C.配制250 mL 1.0 mol/L的稀硫酸需取该硫酸约13.6mL
D.该硫酸溶液可作H2S的干燥剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com