
【题目】已知二甲苯的结构: 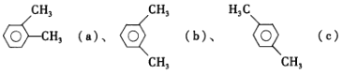 ,下列说法正确的是
,下列说法正确的是
A.a的同分异构体只有b和c两种
B.在三种二甲苯中,b的一氯代物种数最多
C.a、b、c 均能使酸性 KMnO4溶液、溴水发生化学反应而褪色
D.a、b、c 中只有c 的所有原子处于同一平面
【答案】B
【解析】
A.a的同分异构体中属于芳香烃的除了b和c外还有![]() ,另a还可能有链状的同分异构体如CH2=CH—CH=CH—CH=CH—CH=CH2等、或环状的同分异构体如
,另a还可能有链状的同分异构体如CH2=CH—CH=CH—CH=CH—CH=CH2等、或环状的同分异构体如![]() 等,A错误;
等,A错误;
B.a、b、c侧链上的一氯代物都只有1种,a苯环上一氯代物有2种,b苯环上一氯代物有3种,c苯环上一氯代物只有1种,故三种二甲苯中,b的一氯代物种数最多,B正确;
C.a、b、c均能被酸性KMnO4溶液氧化,使酸性KMnO4溶液褪色,a、b、c都不能与溴水发生化学反应,C错误;
D.a、b、c分子中都含有—CH3,与—CH3中碳原子直接相连的4个原子构成四面体,a、b、c中所有原子都不可能在同一平面上,D错误;
答案选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化学与生产生活社会密切相关。下列说法正确的是
A.一次性医用外科口罩的核心功能层熔喷布以纯净物聚丙烯为主要原料制成
B.在“新冠肺炎战疫”中,将84消毒液和医用酒精混合使用,消毒效果更佳
C.绿色化学的核心是从源头上减少和消除化工生产对环境的污染
D.纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。

(1)该反应是__反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率_(填“增大”“减小”“不变”),原因是__。
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_,E2_,ΔH_(填“增大”“减小”“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.有机化学是研究有机物的组成、结构、性质、制备方法与应用的科学
B.凡是含有碳元素的化合物都属于有机化合物
C.有机物都是从有机体中分离出的物质
D.根据分子中碳原子是连成链状还是环状,把有机物分为脂肪族化合物和芳香族化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式硫酸铬[Cr(OH)SO4nH2O]常用于鞣制皮革,染料工业的活性黑染料、媒染剂。电镀废水中(主要含Cr2O72-、Cr3+、Fe3+、CN-、Cl-,少量Mg2+、Cu2+等离子),提取含铬废水中的铬并制成可用的碱式硫酸铬对污染治理和工业生产具有十分重要的意义。

相关金属离子[co (Mn+)= 01 molL-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Cr3+ | Fe3+ | Mg2+ | Cu2+ |
开始沉淀的pH | 4.3 | 1.9 | 9.1 | 4.7 |
沉淀完全的pH | 5.6 | 3.2 | 11.1 | 6.7 |
回答下列问题:
(1)碱式硫酸铬中Cr的化合价为_________。
(2)“氧化”时需控制反应温度在50℃~90℃,原因___________。H2O2先将CN-氧化为无害气体除去,气体I成分是________;后在碱性条件下将Cr3+ 氧化为CrO42-,滤渣中主要含________ (填相关物质的化学式)。
(3)“酸化”时CrO42-可转化为Cr2O72-,其离子方程式为________。
(4)“离子交换”过程采用钠离子交换树脂,反应原理为Mn+ +nNaR=MRn+nNa+ ,则富集到钠离子交换树脂上的金属阳离子有_________(填离子符号)。
(5)处理1L0.1molL-1Cr2O72- 的废水,理论上需要H2C2O4的物质的量为_______ mol。
(6)废水中含有的Cl-常以K2CrO4溶液为指示剂,用AgNO3标准溶液滴定测其含量,利用Ag+与CrO42-生成的砖红色沉淀指示到达滴定终点。当溶液中Cl- 恰好完全沉淀(浓度等于1.0×10一5molL-1)时,溶液中c (Ag+)为_____molL-1 此时溶液中c(CrO42-)等于_______mo1L-1(已知Ag2CrO4、AgCl的Ksp分别约为2.0×10-12和和2.0×10 -10)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下 ,向 20.00mL 0. 1molL-1 BOH溶液中 滴入 0. 1 mo lL-1 盐酸 ,溶液中由水电离出的 c ( H+ ) 的负对数 [ - l gc水( H+ ) ] 与所加盐酸体积的关系如下图所示,下列说法正确的是
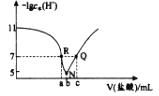
A.常温下,BOH的电离常数约为 1×10-4
B.N 点溶液离子浓度顺序:c(B+)>c(Cl-)> c( OH- )>c( H+)
C.a =20
D.溶液的pH: R > Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在苹果、香蕉等水果的果香中存在着乙酸正丁酯。某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯。实验步骤如下:
(一)乙酸正丁酯的制备
①在50mL 圆底烧瓶中,加入0.15mol正丁醇和 0.12mol 冰醋酸,再加入3~4滴浓硫酸,摇匀,投入1~2粒沸石。按如图所示安装带分水器的回流反应装置, 并在分水器中预先加入水,使水面略低于分水器的支管口。

②打开冷凝水,圆底烧瓶在石棉网上用小火加热。在反应过程中,通过分水器下部的旋塞不断分出生成的水,注意保持分水器中水层液面原来的高度,使油层尽量回到圆底烧瓶中。反应达到终点后,停止加热,记录分出的水的体积。
(二)产品的精制
③将分水器分出的酯层和反应液一起倒入分液漏斗中,用 10 mL 的水洗涤。有机层继续用10 mL10% Na2CO3 洗涤至中性,再用 10 mL 的水洗涤,最后将有机层转移至锥形瓶中,再用无水硫酸镁干燥。
④将干燥后的乙酸正丁酯滤入50 mL 烧瓶中,常压蒸馏,收集 124~126 ℃的馏分,得11.6g产品。
(1)冷水应该从冷凝管_____(填 a 或 b)管口通入。
(2)步骤②中不断从分水器下部分出生成的水的目的是_____。
(3)下列关于分液漏斗的使用叙述正确的是_____。
a.分液漏斗使用前必须要检漏,只要分液漏斗的旋塞芯处不漏水即可使用
b.分液时乙酸正丁酯应从上口倒出
c.萃取振荡操作应如图所示![]()
d.放出液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
(4)该实验过程中,生成乙酸正丁酯(相对分子质量 116)的产率是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10 mL0.1 mol/L的HR溶液中逐滴加入0.1 mol/L的氨水,所得溶液pH及导电能力变化如图。下列分析正确的是( )
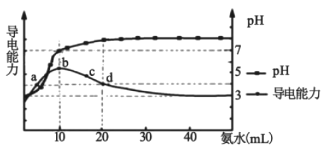
A. 各点溶液中的阳离子浓度总和大小关系:d>c>b>a
B. 常温下,R- 的水解平衡常数数量级为10 -9
C. a点和d点溶液中,水的电离程度相等
D. d点的溶液中,微粒浓度关系:c(R-)+2c(HR)=c(NH3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知:① NaHCO3(s)==Na+(ag)+HCO3-(aq) △H=+18.81kJ·mo1-1
②Na2CO3(s)==2Na+(aq)+CO32-(aq)△H=-16.44 k J· mol-1
③2NaHCO3(s)==Na2CO3(s)+CO2(g)+H2O(1) △H=+92.34kJ·mol-1
请回答:
(1)资料显示,NaHCO3固体加热到100℃发生分解,但是加热 NaHCO3溶液不到80℃就有大量CO2气体放出,用反应热角度说明原因_________________________________。
(2) NaHCO3溶液中主要存在2种化学平衡:a.HCO3-+H2O![]() H2CO3+OH-,b.2HCO3-
H2CO3+OH-,b.2HCO3-![]() CO32-+H2O+CO2。根据理论计算0.10 mol·.L-1 NaHCO3溶液中2个反应的转化率随温度变化如图所示(不考虑相互影响):
CO32-+H2O+CO2。根据理论计算0.10 mol·.L-1 NaHCO3溶液中2个反应的转化率随温度变化如图所示(不考虑相互影响):

①计算25℃0.10mol·L-1NaHCO3溶液中CO2与H2CO3的总浓度最大可能为___________mol·L-1。
②加热蒸干NaHCO3溶液最后得到的固体是___________。
③25℃时0.10mol·L-1的NaHCO3溶液pH=8.3,加热到4分钟溶液沸腾,后保温到7分钟。已知常温下Na2CO3溶液浓度和pH的关系如下表(忽略温度对Kw的影响):
c(mo1·L-1) | 饱和 | 0.20 | 0.10 | 0.010 | 0.0010 |
pH | 12.1 | 11.8 | 11.5 | 11.1 | 10.6 |
请在图中作出 NaHCO3溶液pH随时间变化曲线______________

II.研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图

(1)T℃时,向1L恒容密闭容器中充入0.3 mol CH4,只发生反应2CH4(g)![]() C2H4(g)+2H2(g),达到平衡时,c(C2H4)=c(CH4
C2H4(g)+2H2(g),达到平衡时,c(C2H4)=c(CH4
(2)列式计算反应2CH4(g)![]() C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=___________(用平衡分压代替平衡浓度计算,1g0.05=-1.3)
C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=___________(用平衡分压代替平衡浓度计算,1g0.05=-1.3)
(3)由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com