
分析 (1)COCl2的结构为 ,中心原子C上含有3个σ键,没有孤电子对;分子结构对称正负电荷中心重叠的分子属于非极性分子;分子间存在氢键时熔沸点较高;
,中心原子C上含有3个σ键,没有孤电子对;分子结构对称正负电荷中心重叠的分子属于非极性分子;分子间存在氢键时熔沸点较高;
(2)根据元素的外围电子排布分析;
(3)等电子体的结构相似,离子中含有一个三键,则含有2个π键;
(4)根据离子半径和电荷分析,电荷越多、离子半径越小其熔点越高.
解答 解:(1)COCl2的结构为 ,中心原子C上含有3个σ键,没有孤电子对,属于sp2杂化,其分子构型为平面三角形,甲醇四面体结构和氨气为三角锥结构,甲醛为平衡三角形,二氧化碳为直线型,则甲醛的空间构型与COCl2相同;
,中心原子C上含有3个σ键,没有孤电子对,属于sp2杂化,其分子构型为平面三角形,甲醇四面体结构和氨气为三角锥结构,甲醛为平衡三角形,二氧化碳为直线型,则甲醛的空间构型与COCl2相同;
分子结构对称正负电荷中心重叠的分子属于非极性分子,甲醇、甲醛、氨气属于极性分子,二氧化碳属于非极性分子;
甲醛分子间只有范德华力,甲醇分子间存在范德华力和氢键,分子间存在氢键时熔沸点较高,则甲醇的熔沸点比甲醛高,所以通常情况下甲醇呈液态而甲醛呈气态;
故答案为:B;D;甲醇分子间形成了氢键,增大了分子间的作用力,使熔沸点升高;
(2)Fe的外围电子排布为3d64s2,含有4个未成对电子,Al的外围电子排布为3s23p1,含有一个未成对电子,Cu的外围电子排布为3d104s1,含有一个未成对电子,所以Fe的未成对电子最多;
故答案为:Fe;
(3)CaC2中C22-与O22+互为等电子体,等电子体的结构相似,离子中含有一个三键,则含有2个π键,所以1mol O22+中含有的π键数目为2NA;
故答案为:2NA;
(4)离子晶体中电荷越多、离子半径越小其熔点越高,MgO晶体中离子的电荷数大于NaCl,MgO中离子半径比NaCl的小,即离子间的平均距离小于NaCl,所以MgO晶体熔点高于NaCl晶体;
故答案为:MgO中离子半径比NaCl的更小,所带电荷更多,晶格能更大,则熔沸点更高.
点评 本题考查了杂化类型的判断、分子的极性、氢键、电子排布、等电子体、熔点比较等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力,题目难度中等.


科目:高中化学 来源: 题型:填空题
 ;该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,是已知X能使品红溶液褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,上述过程对应的化学方程式为2S2Cl2+2H2O=SO2↑+4HCl+3S↓;某研究小组同学为确定干燥的X和Y混合气体中Y的存在,设计方案如下:把干燥的X和Y与干燥的NH3混合,出现白烟,则证明有Y气体,你认为此方案正确(填“正确”或“不正确”),理由是干燥的二氧化硫不与氨气反应,但干燥的氯化氢与氨气反应生成白烟.
;该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,是已知X能使品红溶液褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,上述过程对应的化学方程式为2S2Cl2+2H2O=SO2↑+4HCl+3S↓;某研究小组同学为确定干燥的X和Y混合气体中Y的存在,设计方案如下:把干燥的X和Y与干燥的NH3混合,出现白烟,则证明有Y气体,你认为此方案正确(填“正确”或“不正确”),理由是干燥的二氧化硫不与氨气反应,但干燥的氯化氢与氨气反应生成白烟.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
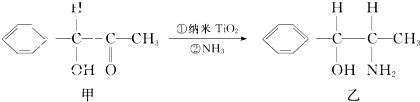
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(Kj.mol-1) | 786 | 715 | 3401 |
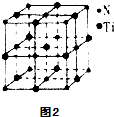
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中还原产物只有SO2 | |
| B. | 反应②中Cu2S只发生了氧化反应 | |
| C. | 将1 molCu2S冶炼成 2mol Cu,需要O21mol | |
| D. | 若1molCu2S完全转化为2molCu,则转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
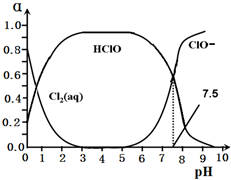 元素周期表中ⅦA族元素的单质及其化合物的用途广泛.
元素周期表中ⅦA族元素的单质及其化合物的用途广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
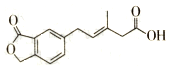
| A. | M可以发生加成、加聚、水解、酯化等反应 | |
| B. | l mol M最多可以与3 mol NaOH反应 | |
| C. | M苯环上的一氯取代物有两种不同结构 | |
| D. | l molM最多可以与5 mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
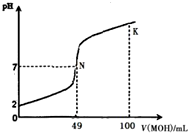 酸碱中和滴定是最基本的定量分析化学实验.常温下,向50mL 0.5mol•L-1 HA溶液中逐滴加入0.5mol•L-1强碱 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列叙述正确的是( )
酸碱中和滴定是最基本的定量分析化学实验.常温下,向50mL 0.5mol•L-1 HA溶液中逐滴加入0.5mol•L-1强碱 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列叙述正确的是( )| A. | 由图中信息可知 HA为强酸,N点为恰好中和 | |
| B. | 常温下一定浓度的 MA稀溶液的pH<7 | |
| C. | K点所对应的溶液中离子浓度的大小关系:c(M+)>c(OH-)>c(A-)>c(H+) | |
| D. | K点对应的溶液中,溶液的pH>13,c(HA)+c(A-)=0.25mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 金属 质量/g | 金属状态 | c(H2SO4) /mol•L-1 | V(H2SO4)/mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的金属性比Y的金属性强 | |
| B. | 常温下,X和Y都不能从水中置换出氢 | |
| C. | Y元素的氢氧化物碱性比X 元素的氢氧化物碱性强 | |
| D. | X元素的最高化合价比Y 元素的最高化合价低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com