
 CH3OH(g) ΔH
CH3OH(g) ΔH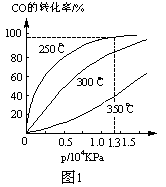
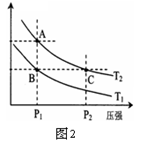
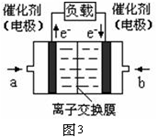


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.①④ | B.①②④ | C.①②④⑤ | D.①②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g) △H="-92" kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)
2NH3(g) △H="-92" kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)| A.升高温度 | B.使用催化剂 |
| C.及时移出氨 | D.循环利用和不断补充氮气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
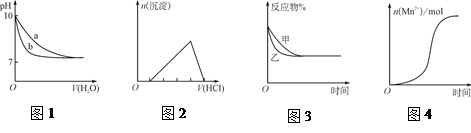
| A.图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中a表示氨水稀释时pH的变化曲线 |
| B.图2表示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀物质的量与盐酸体积的关系 |
C.图3表示压强对可逆反应CO(g)+H2O(g)  CO2(g)+H2(g)的影响,乙的压强比甲的压强大 CO2(g)+H2(g)的影响,乙的压强比甲的压强大 |
| D.图4表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;
Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
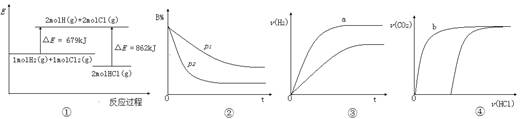
| A.①表示反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的△H="183" kJ·mol-1 |
B.②表示其它条件不变时,反应4A(g)+3B(g) 2C(g)+6D在不同压强下B%(B的体积分数)随时间的变化,则D一定是气体 2C(g)+6D在不同压强下B%(B的体积分数)随时间的变化,则D一定是气体 |
| C.③表示体积和pH均相同的HCl、CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示的是HCl溶液 |
| D.④表示10 mL 0.1 mol·L-1 Na2CO3和NaHCO3两种溶液中,分别滴加0.l mol/L HCl溶液时,CO2的体积随盐酸体积的变化,则b表示的是NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 物质 n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com