
【题目】工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)△H=a kJ/mol 在温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:下列说法不正确的是( )
温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
A.10 min内,T1时CH4的化学反应速率比T2时小
B.温度:T1<T2
C.a<0
D.平衡常数:K(T1)<K(T2)
【答案】D
【解析】A.10 min内,T1时υ(CH4)= ![]() =0.015molL﹣1min﹣1,T2时时υ(CH4)=
=0.015molL﹣1min﹣1,T2时时υ(CH4)= ![]() =0.02molL﹣1min﹣1,T1时υ(CH4)比T2时小,故A不符合题意;
=0.02molL﹣1min﹣1,T1时υ(CH4)比T2时小,故A不符合题意;
B.温度升高,反应速率加快,因此T2>T1,故B不符合题意;
C.温度升高,甲烷剩余量增多,说明反应向左进行,正反应放热,所以a<0,故C不符合题意;
D.T1时反应进行的更为彻底,因此平衡常数更大,K(T1)>K(T2),故D符合题意;
故答案为:D.
A.根据表中数据计算不同温度下的反应速率,然后进行比较即可;
B.根据温度对化学反应速率的影响进行判断;
C.根据温度对化学平衡的影响进行判断;
D.根据温度对化学平衡的影响,判断化学平衡常数的变化即可.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)2SO3(g)△H=a kJmol﹣1 , 反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答: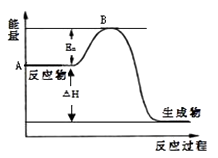
(1)图中A点表示 , a= .
(2)Ea的大小对该反应的△H(填“有”或“无”)影响.
(3)已知常温常压下单质硫的燃烧热为296kJmol﹣1 , 由单质硫和氧气经两步反应,生成3mol SO3(g),放出的总热量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示。
X | Y | ||
Q | Z |
这4种元素的原子最外层电子数之和为22。据此回答下列问题:
(1)Q的单质常用于制作半导体,则Q在元素周期表中的位置为________。
(2)X的最低价氢化物的结构式为__________。
(3)Q、X、Z的最高价含氧酸中,酸性最强的是____________。
(4)X、Y和氢3种元素形成的化合物中既含有离子键又含有共价键的是________(任写一种的化学式)。
(5)X的简单氢化物与Y的单质在催化加热条件下反应生成两种氧化物,该反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柔红酮是一种医药中间体,其结构简式如图所示。下列说法正确的是( )
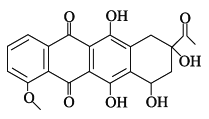
A. 每个柔红酮分子中含有 1 个手性碳原子(连有四个不同基团的碳原子)
B. 柔红酮分子中所有的碳原子都在同一个平面上
C. 一定条件下柔红酮可发生氧化、加成、消去反应
D. 1 mol 柔红酮最多可与 4 mol 氢溴酸发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙醇制取环乙二酸乙二酯时,最简便的流程需要下列哪些反应,其正确的顺序是:①取代;②加成;③氧化;④还原;⑤消去;⑥酯化;⑦中和
A. ①②③⑤⑦ B. ⑤②①③⑥ C. ⑤②①④⑦ D. ①②⑤③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,某容积固定的密闭容器中,建立下列化学平衡:C(s)+H2O(g)![]() CO(g)
CO(g)
+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是( )
A. 体系的压强不再发生变化
B. v正(CO)=v逆(H2O)
C. 生成n mol CO的同时生成n mol H2
D. 1 mol H—H键断裂的同时断裂2 mol H—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源.
(1)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.已知:H2(g)+Cl2(g)=2HCl(g)△H=﹣a kJmol﹣1;E(H﹣H)=b kJmol﹣1 , E(Cl﹣Cl)=c kJmol﹣1 , 则:E(H﹣Cl)=;
(2)氯原子对O3的分解有催化作用:O3(g)+Cl(g)=ClO(g)+O2(g)△H1 , ClO(g)+O(g)=Cl(g)+O2(g)△H2 , 大气臭氧层的分解反应是O3+O=2O2△H.该反应的能量变化示意图如图1所示.则反应O3(g)+O(g)=2O2(g)的正反应的活化能为kJmol﹣1 . 
(3)实验中不能直接测出由石墨和氢气反应生成甲烷反应的反应热,但可测出CH4、石墨和H2燃烧反应的反应热,求由石墨生成甲烷的反应热.已知:
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣a kJmol﹣1
②C(石墨)+O2(g)═CO2(g)△H=﹣b kJmol﹣1
③H2(g)+ ![]() O2(g)═H2O(l)△H=﹣c kJmol﹣1
O2(g)═H2O(l)△H=﹣c kJmol﹣1
则反应C(石墨)+2H2(g)→CH4(g)的反应热:
△H=kJmol﹣1 .
又已知:该反应为放热反应,△H﹣T△S可作为反应方向的判据,当△H﹣T△S<0时可自发进行;则该反应在什么条件下可自发进行 . (填“低温”、“高温”)
(4)有图2所示的装置,该装置中Cu极为极;当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com