
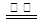 CO2(g)����H��E1 ��
CO2(g)����H��E1 ��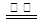 H2O(g)����H��E3 ��
H2O(g)����H��E3 ��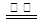 CO2(g)����H��E4�ܡ����Իش��������⣺
CO2(g)����H��E4�ܡ����Իش��������⣺ _____������ڡ��������ڡ�����С�ڡ���;��II�ų���������
_____������ڡ��������ڡ�����С�ڡ���;��II�ų��������� ��_____________________________________��
��_____________________________________�� ���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��H��Cl��H + Cl | B��H + H��H��H |
| C��Zn + H2SO4 = ZnSO4 + H2 �� | D��HCl+ NaOH =" NaCl+" H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(1)DH=+28.6kJ/mol |
| B��NaOH(aq)+HCL(aq) = NaCl(aq)+H2O(1)DH=��28.6kJ/mol |
| C��NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(1)DH=+57.2kJ/mol |
| D��NaOH(aq)+HCl(aq) = NaCl(aq)��H2O(1)DH=��57.2kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��a>b | B��a=b | C��a<b | D�����ʯ��ʯī�ȶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����



 ��Һ��Ũ��ӦΪ mol/L��
��Һ��Ũ��ӦΪ mol/L���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
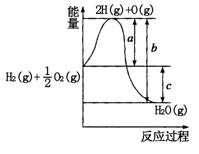
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ѡ�� | ʵ����ʵ | ���� |
| A | Na2S2O3��Һ��ϡH2SO4��Һ���ʱ������������ͬ��Na2S2O3��ҺŨ��Խ���������������ʱ��Խ�� | ��������������ʱ������Ӧ��Ũ�Ȼ�ѧ��Ӧ���ʼӿ� |
| B | �ڻ�ѧ��Ӧǰ�����������ͻ�ѧ���ʶ�û�з����ı� | ����һ�����μӻ�ѧ��Ӧ |
| C | ��NH4Cl������Ba(OH)2.8H2O�����Ϻ���ĥ���ձ����¶Ƚ��� | �÷�ӦΪ���ȷ�Ӧ |
| D | ���ݻ��ɱ���ܱ������з�����Ӧ H2��g��+ I2��g��  2HI��g���� 2HI��g�������ݻ���Сһ�� | ����Ӧ���ʼӿ죬�淴Ӧ���ʲ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������������Ӧ | B��þ�����ᷴӦ |
| C���������������Ʒ�Ӧ | D�����������������Ȼ�茶��巴Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A���Ͼɵ��Ӧ���� ���գ��������� ���գ��������� |
| B������طŵ�ʱ������ת��Ϊ��ѧ�� |
C�����ڱ����е�ʳƷ�����ڽϳ��������¶ȶԷ�Ӧ���ʵ�Ӱ���� �� �� |
| D������ȼ�շ�Ӧ���Ƿ��ȷ�Ӧ�����Բ������������Ϳ��Խ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com