
����Ŀ��Ԫ���ǹ������������������һ�����ʵġ�ԭ���ϡ���
��1����18������������ѧ���Dz���̽��Ԫ��֮�ա�ͨ���Ӿֲ���ϵͳ���о����̣�������Ԫ��֮���������ϵ�������г��˼�λ�ܳ���ѧ�ҵ��о�������
��� | �� | �� | �� | �� |
��ѧ | Ŧ���� | ������ | �±����� | �йŶ��� |
���� | ���֡�����������ָ����ijһָ����Ԫ���𣬵ڰ˸�Ԫ���ǵ�һ��Ԫ�ص�ij���ظ� | ��������ԭ���������ȿ�ʼ���ԭ�������IJⶨ���� | ������5���������Ƶġ���Ԫ���������м�Ԫ�ص����ԭ������Ϊǰ������Ԫ�����ԭ������������ƽ��ֵ | ��Ϊ��Ԫ����֮�䲢�Ǻ�����أ����������ԭ�����������ǰ���С�����˳���� |
������ѧ�ҵ��о�����ʱ���Ⱥ������������_________����������ţ���
��2��1869�꣬�Ž��з���ǰ���о��Ļ������Ƴ��˵�һ��Ԫ�����ڱ�����ͼ��ʾ��
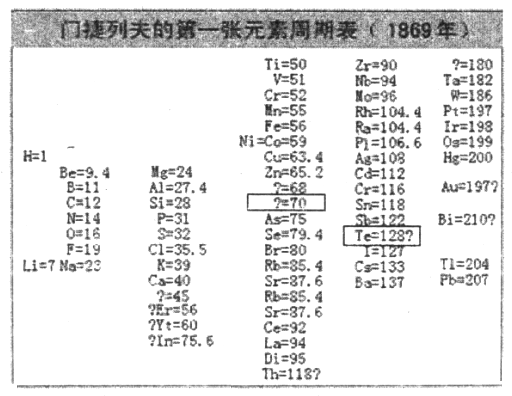
���Ž��з�����Ԫ�ذ������ԭ����������ͬһ___________������С������С���Ԫ���������ơ���ϱ�����Ϣ�������4�з����С�����70�����ʺű���ĺ�����_______________����5�з����С�Te��128�������ʺű���ĺ�����_______________��
�ڵ�20���ͳ����Ž��з����ڱ���Ϊδ֪Ԫ�����µĿ�λ�����������ң�����ԭ�ӽṹ�����أ���ѧ���Ƿ�����Ԫ�����ʲ����������ԭ�������������������Ա仯����������ԭ���������˵�������������������Ա仯���䱾��ԭ����_______________������ĸ��ţ���
A. ���ź˵����������ԭ�Ӻ�������Ų����������Ա仯
B. ���ź˵����������ԭ�Ӱ뾶���������Ա仯
C. ���ź˵����������Ԫ����Ҫ���ϼ۳��������Ա仯
��3��������Ԫ��A��B��D��E��G��J�����ڱ��е�λ�����£�
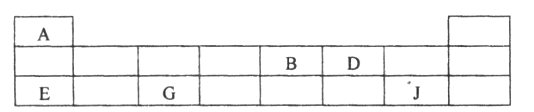
�����ϱ��ش����⣺
��D�����ڱ��е�λ����_______________��
��A��B��E��G��ԭ�Ӱ뾶�ɴ�С��˳����_______________����Ԫ�ط��ţ���
��B��D����̬�⻯����ȶ��Դ�С��ϵΪ_______________���ѧʽ����
��E��G��J������������Ӧˮ��������֮�䷴Ӧ�����ӷ���ʽ�ֱ�Ϊi. H����OH����H2O��ii. _______________��iii_______________��
���õ���ʽ��ʾE�������������γɹ���_______________��
���𰸡� �ڢۢܢ� ���� Ԥ��˴�Ӧ��һ�����ԭ������Ϊ70��Ԫ�� ����Te�����ԭ����������ͬһ�����ԭ���������������˹��ɣ�Te�����ԭ������Ӧ����122��127֮�䣩 A �ڶ����ڣ��ڢ�A�� Na>Al>N>H NH3<H2O Al��OH��3��OH����AlO2����2H2O Al��OH��3��3H����Al3����3H2O ![]()
����������1��1865�꣬Ŧ���ȷ��֡������ɡ���ָ����ijһָ����Ԫ���𣬵ڰ˸�Ԫ���ǵ�һ��Ԫ�ص�ij���ظ���1803�꣬�����ٴ��� ����ԭ���ۣ����ȿ�ʼ���ԭ�������IJⶨ������1829�꣬�±����ɷ�����5���������Ƶġ���Ԫ���顱���м�Ԫ�ص����ԭ������Ϊǰ������Ԫ�����ԭ������������ƽ��ֵ��1862�꣬�йŶ�����Ϊ ��Ԫ����֮�䲢�Ǻ�����أ����������ԭ�����������ǰ���С�����˳��������������ѧ�ҵ��о�����ʱ���Ⱥ�����������Ǣڢۢܢ٣���2���ٽ�ϱ�����Ϣ�ã���������Ԫ�ص����ԭ����������ͬһ����Ԫ���������ƣ���ϱ�����Ϣ�������4�з����С���=70�����ʺű���ĺ��������ԭ������Ϊ70��Ԫ�أ���Te=128��������Te�����ԭ����������128���ʵ�5�з����С�Te=128�������ʺű���ĺ����ǻ���Te�����ԭ����������128���ڿ�ѧ���Ƿ�����Ԫ�����ʲ����������ԭ�������������������Ա仯����������ԭ���������˵�������������������Ա仯���䱾��ԭ�������ź˵����������ԭ�Ӻ�������Ų����������Ա仯���ʴ�Ϊ��A����3��������Ԫ��A��B��D��E��G��J�����ڱ��е�λ�ÿ�֪��A��B��D��E��G��J�ֱ�ΪH��N��O��Na��Al��Cl����O��ԭ�ӽṹ����2�����Ӳ㣬����������Ϊ6����λ�ڵڶ����ڵڢ�A�壻��A��B��E��G��ԭ�Ӱ뾶�ɴ�С��˳����Na>Al>N>H����O�ķǽ����Ա�N��ǿ������N��O����̬�⻯����ȶ��Դ�С��ϵΪNH3<H2O����E��G��J������������Ӧˮ����ֱ�ΪNaOH��Al��OH��3��HClO4������֮�䷴Ӧ�����ӷ���ʽ�ֱ�Ϊi. H����OH����H2O��ii. Al��OH��3��OH����AlO2����2H2O��iii Al��OH��3��3H����Al3����3H2O�����õ���ʽ��ʾE�����������Na2O���γɹ���Ϊ![]() ��
��


 ��ʦ������Ԫ��ĩ���100��ϵ�д�
��ʦ������Ԫ��ĩ���100��ϵ�д� ��У������Ԫͬ��ѵ��������ϵ�д�
��У������Ԫͬ��ѵ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ����ʽ�����ӷ���ʽ��ȷ���ǣ�������
A.��������Һ��ͨ������CO2��2C6H5O��+CO2+H2O��2C6H5OH+CO32��
B.��ȩ��Һ�м���������������Һ�����ȣ�HCHO+2[Ag��NH3��2]++2OH�� ![]() HCOO��+NH4++2Ag��+3NH3+H2O
HCOO��+NH4++2Ag��+3NH3+H2O
C.1һ�ȱ����м�������������Һ�����ȣ�CH3CH2CH2Cl+NaOH ![]() CH3CH=CH2��+NaCl+H2O
CH3CH=CH2��+NaCl+H2O
D.��С�մ���Һ�м�����HCO3��+CH3COOH�TCO2��+H2O+CH3COO��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ص�һ�ֻ�ѧ�ϳɷ����IJ��ֹ���������ͼ��ʾ��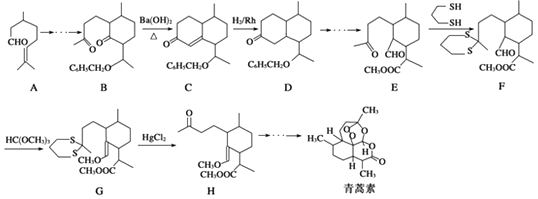
��֪���ʻ���H�ɷ������з�Ӧ�� 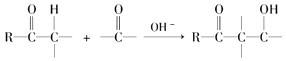 ��
��
��1��������E�к��еĺ���������������ȩ����
��2���ϳ�·�������E��F��G��H��Ŀ���� ��
��3����ӦB����Cʵ���Ͽɿ����������У����η����ķ�Ӧ�������� ��
��4��A��Sn�·�ʯ�����£�������ͬ���칹�������մ�����֪�����մ���������3������̼ԭ�ӣ������մ���������ˮ����1����H2�ӳɿ����� ![]() ���������մ��Ľṹ��ʽΪ ��
���������մ��Ľṹ��ʽΪ ��
��5��д���Ա���ȩ����ϩΪԭ���Ʊ��л���ȩ�� ![]() ���ĺϳ�·������ͼ�����Լ���ѡ����
���ĺϳ�·������ͼ�����Լ���ѡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£������ܱ������н��еĿ��淴Ӧ��2HI��g�� ![]() H2��g��+I2��g��������˵���п��Գ��˵����һ��Ӧ�Ѿ��ﵽ��ѧƽ��״̬���ǣ�������
H2��g��+I2��g��������˵���п��Գ��˵����һ��Ӧ�Ѿ��ﵽ��ѧƽ��״̬���ǣ�������
A.HI��H2��I2��Ũ�����
B.HI��H2��I2��Ũ�Ȳ��ٷ����仯
C.HI��H2��I2���ܱ������й���
D.�������������ɫ���ٷ����仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ��Ŵ���ͭ�����վ�տ���кܸߵ�������ֵ����ʷ��ֵ������������ͭ������ܵ�������ʴ���ʶ���������ͷ���������Ҫ���塣�о����֣���ͭ���ڳ�ʪ�����з����绯ѧ��ʴ��ԭ��ʾ��ͼ���£�����˵����ȷ����

A. ��ʴ�����У���ͭ����������
B. CuCl�ڸ�ʴ�����н����˷�Ӧ���ʱ�
C. ������4.29 g Cu2��OH��3Cl���������Ϻ������Ϊ0.448L
D. ����״Ag2OͿ�ڱ���ʴ��λ�����Է�ֹ��ͭ����һ������ʴ��Ag2O����㷢�����ֽⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڡ��۲�DNA��RNA��ϸ���еķֲ���ʵ���У�ʹ�������Ŀ���� ( )
�ٸı�ϸ��Ĥ��������
�ڸı�ϸ��Ĥ��ͨ��
�۸ı�ϸ��Ĥ�Ļ�ѧ���
�ܽ�DNA�뵰���ʷ���
�ݽ�RNA�뵰���ʷ���
������RNA��Ⱦɫ�����
�����ڵ�������Ⱦɫ�����
������DNA��Ⱦɫ�����
A���٢ܢ� B���ڢܢ� C���ۢݢ� D���ڢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1828�꣬�¹���ѧ�Ҹ������ϣ��ά���״�ʹ��(NH4)2SO4�������KCNO�˹��ϳ�������CO(NH2)2���������л��������"������"ѧ˵��
��1�� (NH4)2SO4��KCNO�ϳ����ط�Ӧ�Ļ�ѧ����ʽΪ____________��
��2��ijС��ͬѧ��ʵ���������£�����CO2��NH3���ڴ����������ºϳ�������
����CO2��NH3�ϳ����� CO(NH2)2��Ӧ�Ļ�ѧ����ʽΪ____________��
��ʵ�������CO2���ö���װ�����Ʊ���Ҫ��ﵽ���濪���á������ͣ����Ŀ�ģ�����װ��A��B��C��D��E�з���Ҫ�����____________������ĸ����
������Fװ���ռ�������������Ӧ�ɵ��ܿ�____________������a������b�������롣




��3��������Ʒ�е����������ü�ȩ���궨����ԭ�����£�������Ũ����ֽ�������ʹ��Һ�еİ���������鱗��ų�������̼���������������кͺ�õ�������Σ����ü�ȩ��HCHO��������������������μ����������(CH2)6N4H+���������ñ�����������Һ�ζ���
�ټ�ȩ������立�Ӧ�����ӷ���ʽΪ____________��
�ڵζ�ѡ�õ�ָʾ��Ϊ____________���ζ��յ������Ϊ____________��
������ȡ��Ʒm g���ܽ�����250mL��Һ��ȡ25.00mL��Ʒ��Һ��250 mL��ƿ�У�����10mL w%�ļ�ȩ��Һ����ַ�Ӧ����1��2��ָʾ������Ũ��Ϊa mol/L��NaOH����Һ�ζ����յ㣨��֪�ζ�ʱ��1 mol���μ����������(CH2)6N4H+����OH����������1mol H+�൱�����ظ�2�Σ�����NaOH����Һ�����ƽ��ֵΪb mL�������Ʒ�е�����������Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.�ǽ���Ԫ��֮�乹�ɵĻ����ﶼ�������ӻ�����
B.����������ͨ�������������γɵĻ�ѧ�������Ӽ�
C.���ӻ�������һ��û�й��ۼ�
D.���������ӵĻ�����һ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л���ѧ��Ӧ�У�ͨ�����л��������ʧȥ��ԭ�ӻ������ԭ�ӵķ�Ӧ����������Ӧ����֮������ԭ��Ӧ��������������ϩ�������ұ������ⷴӦ:![]() ������Ӧ���ȣ������������Ӧ����������������ʱ������˵����ȷ����
������Ӧ���ȣ������������Ӧ����������������ʱ������˵����ȷ����
A. �÷�Ӧ���ڻ�ԭ��Ӧ B. �ұ�����ʽC8H11
C. ����ϩ���16��ԭ�ӹ�ƽ�� D. ���淴Ӧ�����ڼӳɷ�Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com