
【题目】下列说法不正确的是
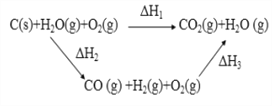
A. ΔH1=ΔH2+ΔH3
B. ΔH1<0 、 ΔH2>0 、 ΔH3<0
C. 将煤转化为 H2(g) 和 CO(g)后燃烧比煤直接燃烧放出热量多
D. 将煤转化为水煤气后再燃烧,从提高煤燃烧利用率看是得不偿失
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】
对羟基苯甲酸丁脂(俗称尼泊金丁酯)可用作防腐剂,对酵母和霉菌有很强的抑制作用,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得,以下是某课题组开发的从廉价、易得的化工原料出发制备对羟基苯酸丁酯的合成路线:

已知以下信息:
通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基;D可与银氨溶液反应生成银镜; F的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积比为1∶1。回答下列问题:
(1)A的化学名称为__________;
(2)由B生成C的化学反应万程式为_____________________,该反应的类型为__________;
(3)D的结构简式为__________;
(4)F的分子式为__________;
(5)G的结构简式为__________;
(6)E的同分异构体中含有苯环且能发生银镜反应的共有__________种,其中核磁共振氢谱有三种不同化学环境的氢,且峰面积比为2∶2∶1的是_____________(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式如图,下列关于该有机物的说法正确的是
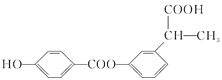
A. 1 mol 该有机物含有 6 mol 碳碳双键
B. 1 mol 该有机物完全燃烧可生成9 mol H2O
C. 1 mol 该有机物可电离生成2 mol H+
D. 1 mol 该有机物最多可与6 mol H2 发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
实验 序号 | 锌的质量/g | 锌的状态 | c(H2SO4) /mol·L-1 | V(H2SO4) /mL | 反应前溶 液的温度/℃ | 添加剂 |
1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴CuSO4溶液 |
(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过定量测定______________________进行判断,其速率最快的实验是________(填实验序号)。
(2)对锌和稀硫酸反应,实验1和2表明,________对反应速率有影响;实验1和3表明,________对反应速率有影响。
(3)进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间 t的图像如下图所示。
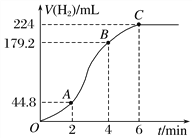
①在OA、AB、BC三段中反应速率最快的是________,原因是______________________。
②2~4 min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)为________________________________________________________________________。
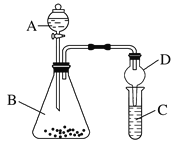
(4)利用如图2装置验证非金属性:C>Si,B中加Na2CO3,C中加Na2SiO3溶液,A中应该加入__________________________,C中反应的化学方程式:________________________,D装置的作用是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,表中列出11种元素在周期表中的位置,按要求回答下列各题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑧ | ||||||
3 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
4 | ② | ④ | ⑩ |
(1)这11种元素中,化学性质最不活泼的元素是______(填元素符号,下同),得电子能力最强的原子是______,失电子能力最强的单质与水反应的化学方程式是___________________,常温下单质为液态的非金属单质是____________。
(2)元素④的离子结构示意图为__________________。
(3)⑥⑦⑧气态氢化物的化学式分别为________、________、________,其中以
(4)写出③的单质置换出⑥的单质的化学方程式:__________________。
①和⑤两种元素最高价氧化物对应的水化物相互反应的离子方程式为_____________。
②和⑨两种元素最高价氧化物对应的水化物相互反应的离子方程式为_____________。
②的最高价氧化物对应水化物的水溶液与⑤的最高价氧化物反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为模拟海水制备 MgO,某同学设计并完成了如下实验:
模拟海水中离子c(mol/L) | Na+ | Mg2+ | Ca2+ | Cl― | HCO3 |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
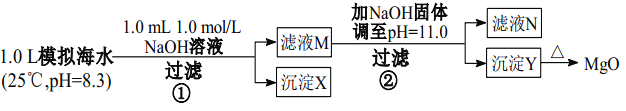
下列说法正确的是
A. 模拟海水呈碱性,可说明 HCO3-的电离能力大于水解能力
B. 沉淀物 X 为 CaCO3,沉淀物 Y 为 Mg(OH)2
C. MgCO3的溶解度比 Mg(OH)2 的小
D. 滤液 M 中存在 Mg2+,不存在 Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家正在研究温室气体CH4和CO2的转化和利用。请回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用____________形象化描述。在基态14C原子中,核外存在___________对自旋相反的电子。
(2)CH4和CO2所含的三种元素电负性从小到大的顺序为__________________________。
(3)一定条件下,CH4和CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物俗称“可燃冰”。
参数 分子 | 分子直径/nm | 分子与H2O的结合能E/kJ·mol-1 |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
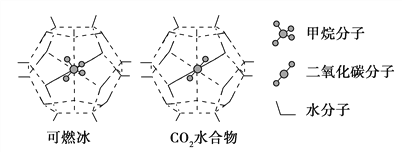
①下列关于CH4和CO2的说法正确的是________(填序号)。
a.CO2分子中含有2个σ键和2个π键
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d.CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0. 586 nm,根据上述图表所提供的数据分析,提出该设想的依据是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、甲醇既是重要的化工原料,又可作为燃料,利用CO和H2在催化剂作用下可合成甲醇(g)。
(1)已知相关的化学键键能数据如下:
化学键 | H—H | C—O | C≡O | H—O | C—H |
E(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
合成甲醇(g)的热化学方程式为______________________________________________。
(2)500K、101KPa条件下,反应过程中测得n(CO)、n(H2)、n(CH3OH)随时间t变化的关系如图甲所示。现保持其它条件不变,起始只改变温度,在改变的这个温度下反应至t1时刻,此时n(H2)比图象中的值大,那么该温度可能是________。
A、700K B、373K C、以上均不对
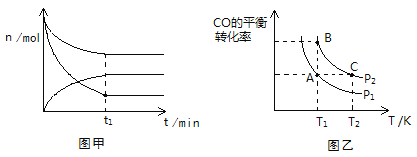
(3)在一容积可变的密闭容器中充入1 mol CO和2 mol H2,发生反应并达到平衡,CO的平衡转化率随温度(T)和压强(P)的变化曲线如图乙所示。P1、P2的大小关系为________;A、B、C三点的平衡常数(K)大小关系为______________________。
Ⅱ、可逆反应:①X(g)+2Y(g)![]() 2Z(g);②2M(g)
2Z(g);②2M(g)![]() N(g)+P(g),分别在密闭容器的两个反应室中进行,反应室之间放有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g),分别在密闭容器的两个反应室中进行,反应室之间放有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
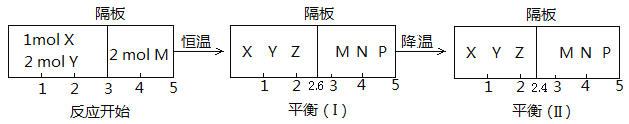
(4)反应①的正反应ΔH______0(填“>”或“<”)。
(5)反应开始时体系的压强与达平衡(Ⅰ)时体系的压强之比为_________(用分数表示)。
(6)在平衡(Ⅰ)和平衡(Ⅱ)中,M的体积分数(Ⅰ)______(Ⅱ)。
A、大于 B、小于 C、等于 D、无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com