
下图为元素周期表的一部分,根据元素①~⑧在周期表中的位置,按要求回答下列问题。
| 族 周期 | IA | | 0 | |||||
| 1 | ① | IIA | IIIA | ⅣA | VA | ⅥA | VIIA | |
| 2 | | | | | | ② | ③ | |
| 3 | ④ | ⑤ | | | | ⑥ | ⑦ | ⑧ |
| | 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | ||||
| 第一组 | 1 | 40 | FeCl3溶液 | 快速产生大量气泡 | 相同条件下,温度升高,化学反应速率加快 |
| 2 | 20 | A | 缓慢产生适量气泡 | ||
| 3 | 5 | FeCl3溶液 | 缓慢产生极少量气泡 | ||
| 第二组 | 4 | t | MnO2 | 快速产生大量气泡 | |
| 5 | 20 | 无 | 缓慢产生极少量气泡 | ||
(10分,化学方程式2分,其余每空1分)(1)Na Ar
(2)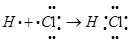 (3)Na>S>F (4)①温度 ②FeCl3溶液 ③20
(3)Na>S>F (4)①温度 ②FeCl3溶液 ③20
④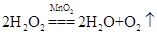 ⑤在20℃(或相同条件下),MnO2可以加快H2O2分解的反应速率。
⑤在20℃(或相同条件下),MnO2可以加快H2O2分解的反应速率。
解析试题分析:根据元素在周期表中的相对位置,元素①~⑧分别是H、O、F、Na、Mg、S、Cl、Ar。
(1)同周期自左向右金属性逐渐降低,同主族自上而下,金属性逐渐升高,所以在元素①~⑧中,金属性最强的元素是Na。最不容易形成化合物的元素是稀有气体元素Ar。
(2)氯元素的气态氢化物是氯化氢,含有共价键的共价化合物,其形成过程可表示为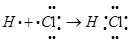 。
。
(3)同周期自左向右,原子半径逐渐减小,同主族自上而下,原子半径逐渐增大,所以③、④、⑥中原子半径由大到小的顺序是Na>S>F。
(4)①第一组中不同的是温度,因此实验目的是:相同条件下,探究温度对该反应速率的影响。要探究温度对电反应速率对影响,则其它条件都是相同的,因此A是氯化铁溶液。
②第二组实验中中不同的催化剂,因此是探究催化剂对反应速率影响的,因此实验4的温度t仍然是20℃,反应的化学方程式是2H2O2MnO2 2H2O+O2↑。根据实验现象可知,加入催化剂后,能快速的产生大量气泡,所以 结论就是在20℃(或相同条件下),MnO2可以加快H2O2分解的反应速率。
考点:考查元素周期表的结构以及元素周期律的应用和判断;外界条件对反应速率影响的实验探究
点评:该题是高考中的常见题型,属于基础性的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,也有利于培养学生规范严谨的实验设计能力。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:
| | | | ||||||
| | | | | | | A | B | |
| C | | | D | E | F | G] | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E五种元素均为短周期元素,原子序数逐渐增大。A形成的单质密度最小(相同条件下)。B可形成多种同素异形体,其中一种的硬度自然界中最大。D元素原子的最外层电子数是次外层电子数的3倍。E元素的最高价氧化物的水化物的酸性强于硫酸。
(1)元素C位于元素周期表的 周期 族,原子结构示意图为 。
(2)B、C、D三种元素的最简单氢化物的稳定性从大到小的顺序是 (填化学式),BE4分子的空间构型是 。
(3)元素A与B形成原子个数比为1:1的相对分子质量最小的化合物的结构式为 。
(4)A、B、C、D几种元素之间可以形成多种10电子微粒,写出上述10电子微粒之间反应的其中一个化学方程式或离子方程式:
(5)写出E的单质制取漂白粉反应的化学方程式并标出电子转移的方向和数目:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与混合,在含有Zn、Cu等元素的催化剂条件下能合成一种生物质能——甲醇。
(1) 与CO互为等电子体的物质的化学式是 。
(2) CO2分子中碳原子的杂化类型是 杂化。
(3) 按电子排布Zn在元素周期表中属于 区,
其晶体属于六方最密堆积,它的配位数是 。
(4) Cu的一种氯化物晶体的晶胞结构如图所示。(空心球代表氯离子),则一个晶胞中所含的数目是 。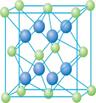
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
W、X、Y、Z为短周期内除稀有气体元素外的四种元素。它们的原子序数依次增大,其中只有Y是金属元素,Y的最外层电子数和W的最外层电子数相等,X、Z为同一主族,Y、Z两种元素的质子数之和为W、X两种元素质子之和的3倍。由此可知元素W为 ,X为 ,Y为 ,Z 。上述元素中任意三种元素组成的既含有离子键又含有共价键的化合物化学式为 (至少写三种)。能形成共价化合物的化学式有 、 、 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D是四种有机物,它们的分子中含有两个碳原子,其中A和B是烃。在标准状况下,A对氢气的相对密度是13,B与HCl反应生成C,C与D混合后加入NaOH并加热,可生成B。
(1)写出A、B、C、D的结构简式。A、 B、 C、 D、
(2)写出有关化学方程式: 、
。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题。
(1)元素D在周期表中的位置是 。
(2)该配位化合物的化学式为 。
(3)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 。
(4)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为 。
(5)已知E的晶胞结构如下图所示,又知晶胞边长为3.61×10-8cm,则E的密度为 ;EDC4常作电镀液,其中DC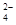 的空间构型是 ,其中D原子的杂化轨道类型是 。
的空间构型是 ,其中D原子的杂化轨道类型是 。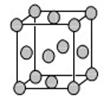
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
【物质结构与性质】
过渡元素具有较多的空轨道,所以第四周期的Cr、Fe、Co、Ni、Cu、Zn等多种金属能形成配合物。
(1)基态Cu原子的核外电子排布式为 ;
(2)科学家通过X射线测得胆矾结构示意图可简单表示如下: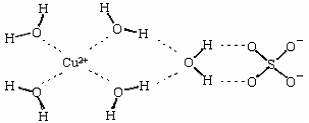
图中虚线表示的作用力为 ;
(3)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在Cu(NH3)4SO4·H2O晶体中,[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团是 ,其中心原子的杂化轨道类型是 ;
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。试推测四羰基镍的晶体类型是 , Ni(CO)4易溶于下列 。
| A.水 | B.四氯化碳 | C.苯 | D.硫酸镍溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com