
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
 .
.分析 根据元素在周期表中的位置可知,①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为S,⑨为Cl,
(1)S的原子结构中有3个电子层,最外层电子数为6;
(2)电子层越多,原子半径越大;同周期原子序数大的原子半径小;
(3)非金属性越强,最高价含氧酸的酸性越强;
(4)③元素所形成单质为氮气;
(5)Al与盐酸反应生成氯化铝和氢气;
(6)⑤元素与⑨元素形成的化合物为NaCl.
解答 解:根据元素在周期表中的位置可知,①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为S,⑨为Cl,
(1)S的原子结构中有3个电子层,最外层电子数为6,S原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)电子层越多,原子半径越大;同周期原子序数大的原子半径小,④、⑤、⑥的原子半径由大到小的顺序为Na>Al>O,故答案为:Na>Al>O;
(3)非金属性越强,最高价含氧酸的酸性越强,则②、③、⑦的最高价含氧酸的酸性由强到弱顺序是HNO3>H2CO3>H2SiO3,故答案为:HNO3>H2CO3>H2SiO3;
(4)③元素所形成单质为氮气,结构式为N≡N,故答案为:N≡N;
(5)Al与盐酸反应生成氯化铝和氢气,离子反应为2Al+6H+=2Al3++3H2↑,故答案为:2Al+6H+=2Al3++3H2↑;
(6)⑤元素与⑨元素形成的化合物为NaCl,只含离子键,故答案为:离子键.
点评 本题考查元素的位置、结构、性质的综合应用,为高频考点,把握元素的位置、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案科目:高中化学 来源: 题型:解答题
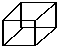 )具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物Ⅰ的一种合成路线:
)具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物Ⅰ的一种合成路线: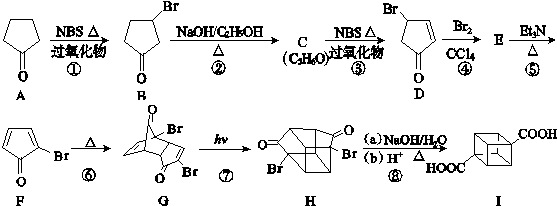
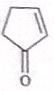 ,E的结构简式为
,E的结构简式为 .
.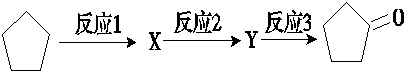
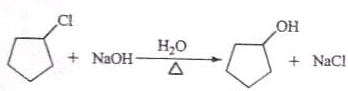 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
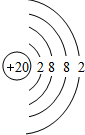 .
.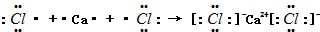 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 单位时间内生成n mo1 O2的同时生成2n mol NO2 | |
| B. | 单位时间内生成n mol O2的同时生成2n mol NO | |
| C. | 混合气体的颜色不再改变 | |
| D. | 混合气体的密度不再改变的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
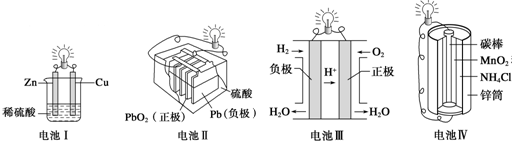
| A. | 电池Ⅰ中锌是负极 | |
| B. | 电池Ⅱ是一次电池 | |
| C. | 电池Ⅲ工作时氢气发生还原反应 | |
| D. | 电池Ⅳ工作时电子由锌通过导线流向碳棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 燃料电池是将乙醇通入负极,O2通入正极而发生电池反应的,其能量转换率高.
燃料电池是将乙醇通入负极,O2通入正极而发生电池反应的,其能量转换率高.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com