
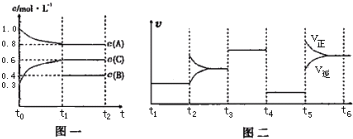
| A、此温度下该反应的化学方程式2A(g)+B(g)?2C(g) | ||||
| B、t4~t5阶段改变的条件为减小压强 | ||||
| C、B 的起始物质的量为1.0mol | ||||
D、在相同条件下,若起始时容器中加入amol A、bmol B 和cmol C,要达到 t1时刻同样的平衡,a、b、c 要满足的条件为a+
|
| 2C |
| 3 |
| C |
| 3 |


科目:高中化学 来源: 题型:
| 甲 | 乙 | 丙 | 丁 | |
| A | Pt | Pt | CuCl2 | HCl |
| B | C | Cu | CuSO4 | CuO |
| C | Pt | C | H2SO4 | H2SO4 |
| D | Fe | Fe | NaCl | NaOH |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 可逆反应在一定条件下达到平衡后,速率差值[即v(正)-v(逆)]与压强的变化曲线如图所示,其中与曲线①相符的反应为( )
可逆反应在一定条件下达到平衡后,速率差值[即v(正)-v(逆)]与压强的变化曲线如图所示,其中与曲线①相符的反应为( )| A、2SO3(g)?2SO2(g)+02(g) |
| B、H2(g)+I2(g)?2HI(g) |
| C、C(s)+H2O(g)?C0(g)+H2(g) |
| D、N2(g)+3H2(g)?2NH3(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
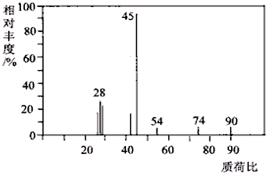 有机物A常用于食品行业.已知9.0g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2.
有机物A常用于食品行业.已知9.0g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.6L |
| B、6.72L |
| C、1.344L |
| D、11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分别滴加0.1 mol?L-1的盐酸,看气泡产生的快慢 |
| B、分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色沉淀生成 |
| C、分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀 |
| D、分别配成溶液,做焰色反应实验,观察火焰的颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
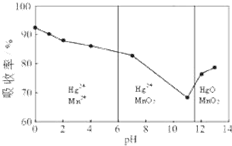 (一)电解饱和食盐水的阳极产物是
(一)电解饱和食盐水的阳极产物是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com