
| A. | 0.1 mol•L-1的BaCl2溶液中:K+、Na+、OH-、NO3- | |
| B. | 使甲基橙变红的溶液中:Ca2+、NH4+、CH3COO-、Cl- | |
| C. | 无色透明的溶液中:Fe2+、SO42-、NO3-、Na+ | |
| D. | 由水电离出的c(H+)=10-12 mol•L-1的溶液中:Mg2+、K+、Br-、HCO3- |
分析 A.离子之间不发生任何反应;
B.使甲基橙变红的溶液呈酸性;
C.有颜色的离子不能大量存在;
D.由水电离出的c(H+)=10-12 mol•L-1的溶液可能呈酸性或碱性.
解答 解:A.BaCl2溶液中离子之间不发生任何反应,可大量共存,故A正确;
B.使甲基橙变红的溶液呈酸性,酸性条件下CH3COO-不能大量共存,故B错误;
C.Fe2+有颜色,不符合题目无色要求,故C错误;
D.由水电离出的c(H+)=10-12 mol•L-1的溶液,水的电离受到抑制,永夜可能呈酸性或碱性,无论呈酸性还是碱性,HCO3-都不能大量共存,故D错误.
故选A.
点评 本题考查离子共存,侧重考查复分解反应、氧化还原反应,为高考高频点,明确离子共存条件及离子性质即可解答,易错选项是D,题目难度不大.


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | Mg和Al | B. | Mg和Zn | C. | Al和Zn | D. | Al和Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有些食物中铁元素含量非常丰富,其中非血红素铁是其存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.
有些食物中铁元素含量非常丰富,其中非血红素铁是其存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
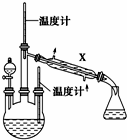 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O):CO(NH2)2+2NaOH+NaClO═Na2CO3+N2H4•H2O+NaCl
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O):CO(NH2)2+2NaOH+NaClO═Na2CO3+N2H4•H2O+NaCl查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COONa溶液中含有少量的CH3COOH | |
| B. | 醋酸钠溶液的pH大于7 | |
| C. | 醋酸钠溶液中滴入酚酞显红色,加热后颜色变深 | |
| D. | 醋酸钠溶液与浓H2SO4微热,可逸出醋酸蒸气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可向海水中加入明矾使海水淡化从而解决淡水供应危机 | |
| B. | 福尔马林可用于浸制标本,是因为其能使蛋白质变性 | |
| C. | 应用酒精的浓度通常为75% | |
| D. | 向烟花中添加含钠、钙、铜等金属元素的化合物可在燃烧时产生绚丽缤纷的效果 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com