
【题目】下列说法正确的是( )
A.0.1mol/LCH3COOH溶液加水稀释,溶液中c(OH﹣)增大
B.将NaOH和氨水溶液各稀释一倍,两者的OH﹣浓度均减少到原来的 ![]()
C.相同浓度的HCl和CH3COOH,两溶液中c(H+)相同
D.甲溶液的pH是5,乙溶液的pH是4,则甲溶液与乙溶液的中c(H+)之比为10:1
【答案】A
【解析】解:A、醋酸加水稀释,溶液酸性减弱,氢离子浓度减小,氢氧根离子浓度增大,故A正确;
B、将NaOH溶液和氨水溶液各稀释一倍,氢氧化钠溶液的OH﹣浓度减少到原来的二分之一,一水合氨存在电离平衡,稀释一倍,电离平衡正向进行,一水合氨溶液的OH﹣浓度大于原来的二分之一,故B错误;
C、盐酸是强酸,醋酸是弱酸存在电离平衡,如果盐酸的浓度是醋酸浓度的二倍,则盐酸的H+浓度比醋酸溶液中氢离子浓度的二倍大,故C错误;
D、甲溶液的pH是5,溶液的c(H+)=10﹣5mol/L,乙溶液的pH是4,溶液的c(H+)=10﹣4mol/L,则甲溶液与乙溶液的c(H+)之比为10﹣5mol/L:10﹣4mol/L=1:10,故D错误;
故选A.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】化学实验装置的科学设计是实验是否取得预期效果的关键.请回答下列有关实验装置的相关问题:
(1)图A为“人教版”教材制备乙酸乙酯的实验装置,某同学甲认为下图B装置进行酯化反应效果比A要好,他的理由是;
某同学乙经查阅资料认为下图C装置进行酯化反应效果更好,他的理由是 . 
(2)某有机物的结构简式如图: ![]()
①当其和反应时,可转化为  .
.
②当其和反应时,可转化为  .
.
③当和反应时,可转化为 ![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水中,水分子可彼此通过氢键形成(H2O)n的小集团。在一定温度下(H2O)n的n=5,每个水分子被4个水分子包围着形成四面体。(H2O)n的n=5时,下列说法中正确的是 ( )
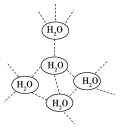
A.(H2O)n是一种新的水分子
B.(H2O)n仍保留着水的化学性质
C.1 mol(H2O)n中有2个氢键
D.1 mol(H2O)n中有4 mol氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定已变质的过氧化钠的纯度,设计如下图所示的实验;Q为一具有良好的弹性气球,称取一定量的样品放于其中,按图安装的实验装置打开分液漏斗的活塞,将稀H2SO4滴入气球中.请填空:
(1)Q内发生反应生成种气体,其中的反应有个氧化还原反应.
(2)为测定反应生成气体的总体积,滴稀H2SO4前必须关闭(填K1、K2或K3 , 下同) , 打开 .
(3)当上述反应停止,将K1、K2、K3处于关闭状态,然后先打开K2 , 再缓缓打开K1 , 这时可观察到的现象是 .
(4)导管a的作用是 .
(5)b中装的固体试剂是 , 为何要缓缓打开K1 .
(6)实验结束时量筒I中有x mL水,量筒II中收集到y mL气体,则过氧化钠的纯度是(体积折算到标准状况).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种高容量的固态锂电池以锂超离子固态导体(组成为Li30GeP2S12)为电解质,该锂电池能在﹣100℃至100℃之间的超宽温度范围内工作.下列说法不正确的是( )
A.Li的原子结构示意图为 ![]()
B.原子半径:P>S
C.酸性:H3PO4<H2SO4
D.Li、Ge、P、S都属于短周期元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些有机化合物的模型如图所示。
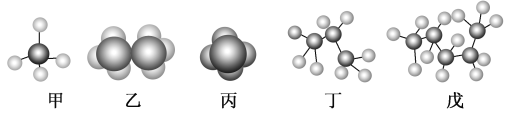
回答下列问题:
(1)属于比例模型的是________(填“甲”、“乙”、“丙”、“丁”或“戊”,下同)。
(2)表示同一种有机化合物的是____________。
(3)存在同分异构体的是___________,写出其同分异构体的结构简式________________________。
(4)含碳量最低的是________,含氢量最低的分子中氢元素的质量分数是________(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1 mol·L-1的某一元酸HA在水中有0.1%发生电离,回答下列各问题:
(1)HA的电离平衡常数K=_____________。
(2)升高温度时,K将_____________(填“增大”、“减小”或“不变”)。(3)由HA电离出的c(H+)约为水电离出的c(H+)的_____________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某气体反应的平衡常数可表示为K=c(CH3OCH3)c(H2O)/[c(CH3OH)]2 , 该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44.
请回答下列问题:
(1)写出上述反应的化学方程式
(2)该反应的正反应是反应(填“放热”或者“吸热”),
(3)已知在密闭容器中,测得某时刻各组分的浓度如下:
物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
浓度/(molL﹣1) | 0.54 | 0.68 | 0.68 |
①此时系统温度400℃,比较正、逆反应速率的大小:v正v逆 (填“>”、“<”或“=”).
②若以甲醇百分含量为纵坐标,以温度为横坐标,此时反应点在图象的位置是图中点.比较图中B、D两点所对应的正反应速率BD(填“>”、“<”或“=”).理由是 . 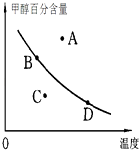
(4)一定条件下要提高反应物的转化率,可以采用的措施是
a.升高温度 b.加入催化剂 c.压缩容器的体积
d.增加水蒸气的浓度 e.及时分离出产物.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2和NOx都是大气污染物.
(1)汽车排放的尾气中含CO和NO,汽车发动机工作时产生的NO和CO可通过催化转化器转化为两种无污染的气体,该反应的化学方程式是
(2)采取还原法,用炭粉可将氮氧化物还原.
已知:N2(g)+O2(g)═2NO(g)△H=+180.6kJmol﹣1;C(s)+O2(g)═CO2(g)△H=﹣393.5kJmol﹣1
则反应C(s)+2NO(g)═CO2(g)+N2(g)△H=kJmol﹣1 .
(3)将NO2变成无害的N2要找到适合的物质G与适当的反应条件,G应为(填写“氧化剂”或“还原剂”).下式中X必须为无污染的物质,系数n可以为0;NO2+G ![]() N2+H2O+nX (未配平的反应式);
N2+H2O+nX (未配平的反应式);
下列化合物中,满足上述反应式中的G是(填写字母);
a.NH3b.CO2c.SO2d.CH3CH2OH
(4)利用氨水可以将SO2和NO2吸收,原理如图1所示:NO2被吸收的离子方程式是 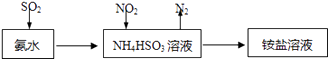
(5)利用图2所示装置(电极均为惰性电极)也可吸收SO2 , 并用阴极排出的溶液吸收NO2 . 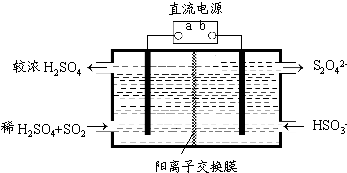
①b极的电极反应式为;
②在碱性条件下,用阴极排出的溶液吸收NO2 , 使其转化为无害气体,同时有SO32﹣生成.该反应离子方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com