
| A. | 决定化学反应速率的主要因素是参加反应的物质的性质 | |
| B. | 升高温度可使吸热反应的反应速率增大,使放热反应的反应速率减小 | |
| C. | 对于有气体参加的反应,增大压强,反应速率加快 | |
| D. | 催化剂能增大单位体积内活化分子的百分数,从而增大化学反应速率 |
分析 A.影响反应速率的主要因素是物质的本身性质;
B.无论是吸热反应还是放热反应,升高温度反应速率都增大;
C.对于有气体参加的反应,增大压强,如气体浓度增大,则反应速率增大;
D.使用催化剂,降低反应所需的活化能.
解答 解:A.影响反应速率的主要因素是物质的本身性质,如钠和冷水剧烈反应,但铁需要高温下才能与水蒸气反应,故A正确;
B.无论是吸热反应还是放热反应,升高温度反应速率都增大,并且正逆反应速率都增大,故B错误;
C.对于有气体参加的反应,若恒容下如气体浓度增大,则反应速率增大,故C正确;
D.使用催化剂,降低反应所需的活化能,增大单位体积内活化分子的百分数,则反应速率加快,故D正确.
故选B.
点评 本题考查影响化学反应速率的因素,为高频考点,把握常见的影响反应速率的外界因素为解答的关键,注重基础知识的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
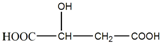
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
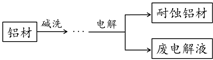 铝自然形成的氧化膜易脱落.以硫酸为电解液,分别以石墨和铝材做阴、阳极材料,经过电解处理形成的氧化铝膜,抗蚀能力强.其制备的简要流程如图.下列用来解释流程中反应的方程式不正确的是( )
铝自然形成的氧化膜易脱落.以硫酸为电解液,分别以石墨和铝材做阴、阳极材料,经过电解处理形成的氧化铝膜,抗蚀能力强.其制备的简要流程如图.下列用来解释流程中反应的方程式不正确的是( )| A. | 碱洗目的是除去铝材表面的自然氧化膜:2OH-+Al2O3═2AlO2-+H2O | |
| B. | 碱洗时铝材表面会出现气泡:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | 获得耐蚀铝材的电极反应为:4Al-12e-+3O2═2Al2O3 | |
| D. | 用稀氨水洗去耐蚀铝材表面的酸:NH3•H2O+H+═NH4++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 2NH3.
2NH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H2S是一种无色、有臭鸡蛋气味、有毒的可燃性气体,高温下可以分解,其水溶液叫氢硫酸(二元弱酸,较强还原性).
H2S是一种无色、有臭鸡蛋气味、有毒的可燃性气体,高温下可以分解,其水溶液叫氢硫酸(二元弱酸,较强还原性).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤②③ | B. | ④②③ | C. | ⑤②④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和稀盐酸反应:2Fe+6H+→2Fe3++3H2↑ | |
| B. | 氯气和溴化钠溶液反应:C12+2Br-→2C1-+Br2 | |
| C. | 氢氧化钡和稀硫酸反应:SO42-+Ba2+→BaSO4↓ | |
| D. | 醋酸和碳酸钙反应:2H++CaCO3→Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com