
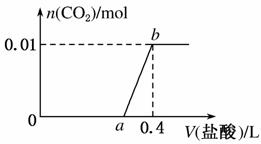
向NaOH和Na2CO3混合溶液中滴加0.1 mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )
A.在0~a范围内,只发生中和反应
B.ab段发生反应的离子方程式为:CO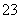 +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
C.a=0.3
D.原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
解析 在0~a范围内,先发生中和反应,后发生CO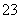 与H+生成HCO
与H+生成HCO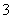 的反应,A项错误;ab段发生反应的离子方程式为HCO
的反应,A项错误;ab段发生反应的离子方程式为HCO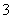 +H+===H2O+CO2↑,B项错误;因a~0.4范围内发生的反应是H++HCO
+H+===H2O+CO2↑,B项错误;因a~0.4范围内发生的反应是H++HCO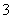 ===CO2↑+H2O,n(CO2)=0.01 mol,n(H+)=n(CO2)=0.01 mol,所以a=0.3,C项正确;由碳元素守恒可知溶液中n(CO
===CO2↑+H2O,n(CO2)=0.01 mol,n(H+)=n(CO2)=0.01 mol,所以a=0.3,C项正确;由碳元素守恒可知溶液中n(CO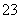 )=n(CO2)=0.01 mol,在0~a范围内,生成0.01 mol HCO
)=n(CO2)=0.01 mol,在0~a范围内,生成0.01 mol HCO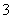 消耗0.1 L稀盐酸,故NaOH消耗稀盐酸的体积为0.2 L,n(OH-)=0.2 L×0.1 mol·L-1=0.02 mol,因此原混合溶液中NaOH与Na2CO3的物质的量之比为2:1,D项错误。
消耗0.1 L稀盐酸,故NaOH消耗稀盐酸的体积为0.2 L,n(OH-)=0.2 L×0.1 mol·L-1=0.02 mol,因此原混合溶液中NaOH与Na2CO3的物质的量之比为2:1,D项错误。
答案 C


科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体
B.CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大
C.Ca(HCO3)2溶液与过量NaOH溶液反应可得到Ca(OH)2
D.25 ℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
在T ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。
又知T ℃时,AgCl的Ksp=4×10-10,下列说法不正确的是( )
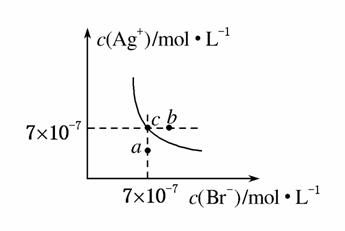
A.在T ℃时,AgBr的Ksp为4.9×10-13
B.图中b点对应的是向AgBr饱和溶液中加入NaBr固体后的溶液
C.图中a点对应的是AgBr的不饱和溶液
D.AgCl沉淀能较容易转化为AgBr沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3·H2O能大量共存 |
| C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关离子方程式与所述事实相符的是 ( )
A.用过氧化氢从酸化的海带灰浸出液中提取碘:2I—+H2O2+2H+==I2+2H2O
B.某溶液中存在大量Fe3+、S2ˉ、Clˉ、Na+,加入NaOH溶液发生反应:Fe3++3OHˉ=Fe(OH)3↓
C.向AlCl3溶液中投入过量的Na: Na+Al3++2H2O=Na++AlO2-+2H2↑
D.将Na2O2固体投入H218O中:2H218O+2Na2O2 = 4OH-+4Na++18O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列平衡体系中,保持温度一定时,改变某物质的浓度,混合气体的颜色会改变;改变压强时,颜色也会改变,但平衡并不移动,这个反应是( )
A.2NO+O2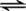 2NO2 B.N2O4
2NO2 B.N2O4 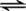 2NO2
2NO2
C.Br2(g)+H2 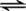 2HBr D.6NO+4NH3
2HBr D.6NO+4NH3 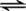 5N2+3H2O
5N2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
根据物质中N元素的化合价判断,下列说法错误的是( )
A.NH3具有还原性
B.N2既具有氧化性又具有还原性
C.N2只具有氧化性
D.HNO3具有氧化性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com