
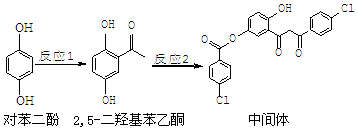
| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1 mol该中间体最多可与11 mol H2反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、水解、缩聚反应 | |
| D. | 该中间体分子中含有羰基和烃基两种含氧官能团 |
分析 A.对苯二酚在空气中易被氧气氧化;
B.中间体中苯环、羰基能和氢气发生加成反应;
C.2,5-二羟基苯乙酮中含有酚羟基、羰基和苯环,能发生取代反应、氧化反应、加成反应、还原反应、缩聚反应;
D.该中间体中含有氯原子、羰基、酯基、酚羟基.
解答 解:A.对苯二酚中含有酚羟基,在空气中易被氧气氧化,故A错误;
B.中间体中苯环、羰基能和氢气发生加成反应,所以1 mol该中间体最多可与11 mol H2反应,故B正确;
C.2,5-二羟基苯乙酮中含有酚羟基、羰基和苯环,能发生取代反应、氧化反应、加成反应、还原反应、缩聚反应,但不能发生水解反应,故C错误;
D.该中间体中含有氯原子、羰基、酯基、酚羟基,有四种官能团,故D错误;
故选B.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查酚、醛的性质,注意酚能和醛发生缩聚反应,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 简单离子的半径:d>c | |
| B. | 单质的沸点:a<b | |
| C. | b、d的氧化物对应的水化物均为强酸 | |
| D. | b、c可形成离子化合物b3c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取用粉末状固体或固体小颗粒时,应用药匙或纸槽,取用块状固体时,应用镊子夹取 | |
| B. | 取用细口瓶里的试液时,先拿下瓶塞,倒放在桌上,然后标签朝外拿起瓶子,瓶口要紧挨着试管口,将液体缓缓地倒入试管 | |
| C. | 胶头滴管取完一种试液后,可直接取另一种不与其反应的试液 | |
| D. | 当某实验没有准确的药品用量说明时,为看到明显现象,取用药品越多越好 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应的氧化剂和还原剂的物质的量之比为3:2 | |
| B. | 被氧化和被还原的元素分别为铜和氮 | |
| C. | 当产生0.2 mol气体时,转移电子为0.6 mol | |
| D. | 被还原的CuO占参与反应CuO的$\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molN2与4 mol H2在一定条件下反应生成NH3的分子数为2NA | |
| B. | 标准状况下,5.6LSO3中含有的原子总数为NA | |
| C. | 1 molCu和足量的硫粉加热反应转移的电子数是2NA | |
| D. | 常温下,4.6g NO2 和N2O4的混合物中氧原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
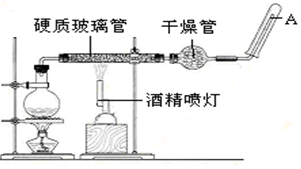
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
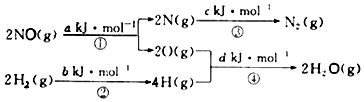
| A. | 0.5(a+b-c-d)kJ/mol | B. | 0.5(c+a-d-b)kJ/mol | ||
| C. | 0.5(c+d-a-b)kJ/mol | D. | 0.5(c+d-a-b)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
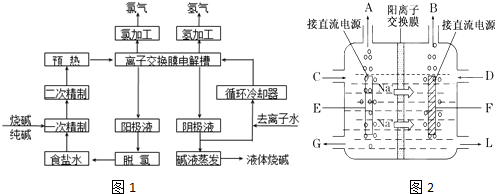
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com