
【题目】(1)用KClO3在H2SO4存在下与SO2反应制得ClO2。请写出反应的离子方程式:______。
(2)把ag固体NaHCO3加热分解一段时间后,固体质量变为b g。
①尚未分解的NaHCO3质量为________g。
②当b为________g时,表明NaHCO3完全分解。
(3)NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:2NaNO2+4HI===2NO↑+I2+2NaI+2H2O。
①上述反应中氧化剂是__________________。
②根据上述反应,鉴别NaNO2和NaCl。可选用的物质有:①水、②碘化钾淀粉试纸、
③淀粉、④白酒、⑤食醋,你认为必须选用的物质有___________(填序号)。
③某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是________(填编号)。
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
④请配平以下化学方程式:________□Al+□NaNO3+□NaOH===□NaAlO2+□N2↑+2H2O。若反应过程中转移5 mole-,则生成标准状况下N2的体积为________L。
【答案】2ClO3-+SO2=2ClO2+SO42- ![]()
![]() NaNO2①②⑤B10 6 4 10 311.2
NaNO2①②⑤B10 6 4 10 311.2
【解析】
(1)KClO3在H2SO4存在下与SO2反应制得二氧化氯,同时生成硫酸钾;(2)反应前固体为NaHCO3,反应后为未反应的NaHCO3和反应生成的Na2CO3的混合物,找到反应物Na2CO3和反应前后固体质量差对应的正比例关系即可迅速解题;(3)氧化还原反应中,化合价降低元素所在的反应物是氧化剂;根据反应时有沉淀、气体、颜色变化等明显现象选择试剂;选择试剂时要考虑既能使NaNO2转化又无二次污染;反应中Al→AlO2-,Al元素化合价由0价升高为+3价,共升高3价,NO3-→N2↑,氮元素化合价由+5价降低为0价,共降低10价,化合价升降最小公倍数为30。
(1)KClO3在H2SO4存在下与SO2反应制得二氧化氯,同时生成硫酸钾,则离子反应为2ClO3-+SO2=2ClO2+SO42-。(2)设分解的碳酸氢钠质量为x,则:
2NaHCO3![]() Na2CO3+CO2↑+H2O △m=—62g
Na2CO3+CO2↑+H2O △m=—62g
168 62
x (a—b)
由化学方程式可知x=![]() ,则尚未分解的NaHCO3质量为a-
,则尚未分解的NaHCO3质量为a-![]() =
=![]() ;NaHCO3完全分解时,生成的碳酸钠的质量为bg,则bg=
;NaHCO3完全分解时,生成的碳酸钠的质量为bg,则bg=![]() g,故b为
g,故b为![]() 。(3)2NaNO2+4HI═2NO+I2+2NaI+2H2O,氮元素的化合价降低,所以NaNO2是氧化剂;①水、③淀粉、④白酒与NaNO2都不反应,所以无明显现象;KI与NaNO2反应生成I2必须在酸性条件下才能反应,食醋会电离出微量的氢离子,碘化钾在食醋本身带的溶剂水中电离出碘离子,亚硝酸钠电离出亚硝酸根与钠离子,发生反应生成碘单质,I2使湿润的淀粉碘化钾试纸变蓝,故选①②⑤;NaNO2→N2是被还原,必须加还原剂,N元素氧化性弱于O和Cl元素,故只能加NH4Cl作还原剂,反应的方程式为NaNO2+NH4Cl═NaCl+N2↑+2H2O,亚硝酸钠中氮得到3电子指向氮气中的氮,氯化铵中氮失去3电子指向氮气中的氮,故选B;反应中Al→AlO2-,Al元素化合价由0价升高为+3价,共升高3价,NO3-→N2↑,氮元素化合价由+5价降低为0价,共降低10价,化合价升降最小公倍数为30,故Al的系数为10,N2系数为3,由氮元素守恒可知系数为6,由Al元素守恒可知系数为10,由电荷守恒可知OH-系数为4,由H元素守恒可知H2O前面的系数为2,故配平后离子方程式为:10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O,转移30mol电子会有3mol氮气生成,根据电子转移守恒,有5mol电子转移时生成氮气的物质的体积为11.2L。
。(3)2NaNO2+4HI═2NO+I2+2NaI+2H2O,氮元素的化合价降低,所以NaNO2是氧化剂;①水、③淀粉、④白酒与NaNO2都不反应,所以无明显现象;KI与NaNO2反应生成I2必须在酸性条件下才能反应,食醋会电离出微量的氢离子,碘化钾在食醋本身带的溶剂水中电离出碘离子,亚硝酸钠电离出亚硝酸根与钠离子,发生反应生成碘单质,I2使湿润的淀粉碘化钾试纸变蓝,故选①②⑤;NaNO2→N2是被还原,必须加还原剂,N元素氧化性弱于O和Cl元素,故只能加NH4Cl作还原剂,反应的方程式为NaNO2+NH4Cl═NaCl+N2↑+2H2O,亚硝酸钠中氮得到3电子指向氮气中的氮,氯化铵中氮失去3电子指向氮气中的氮,故选B;反应中Al→AlO2-,Al元素化合价由0价升高为+3价,共升高3价,NO3-→N2↑,氮元素化合价由+5价降低为0价,共降低10价,化合价升降最小公倍数为30,故Al的系数为10,N2系数为3,由氮元素守恒可知系数为6,由Al元素守恒可知系数为10,由电荷守恒可知OH-系数为4,由H元素守恒可知H2O前面的系数为2,故配平后离子方程式为:10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O,转移30mol电子会有3mol氮气生成,根据电子转移守恒,有5mol电子转移时生成氮气的物质的体积为11.2L。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如图所示的反应关系。下列物质组不满足上述转化关系的是( )
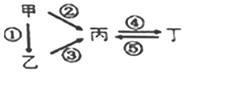
选项 | 甲 | 乙 | 丙 | 丁 |
A | N2 | NH3 | NO | NO2 |
B | Si | SiO2 | Na2SiO3 | Na2CO3 |
C | S | H2S | SO3 | H2SO4 |
D | Al | Al2O3 | NaAlO2 | Al(OH)3 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质对应的电子式书写正确的是( )
A. NH4Br:[NH![]() ][∶B∶]-
][∶B∶]-
B. CaCl2:∶C∶-[Ca2+]∶C∶-
C. N2:NN
D. Na2O2:Na+[∶![]() ∶
∶![]() ∶]2-Na+
∶]2-Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中所用仪器合理的是( )
A.用 100 mL 量筒量取 5.2 mL 盐酸B.用 10 mL 量筒量取 5.2 mL 盐酸
C.用托盘天平称取 25.02 g NaClD.用100 mL 容量瓶配制 50 mL 0.1 mol/L 的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用某些有机物的同分异构体间的转化可用来贮存热能,如原降冰片二烯(NBD)经太阳照射后转化成四环烷(Q)的的反应:![]() △H=+88.62kJ·mol—1 ,下列说法不正确的是:
△H=+88.62kJ·mol—1 ,下列说法不正确的是:
A. NBD、Q、甲苯三者互为同系物
B. NBD、Q、甲苯三者是同分异构体
C. 92gNBD经太阳照射后完全转化为Q时需吸收88.62kJ热量
D. NBD可开发为贮能材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核磁共振谱(NMR)是研究有机化合物结构的最有力手段之一。在所研究化合物的分子中,每一种结构类型的等价(或称为等性)H原子,在NMR谱中都给出相应的峰(信号).谱中峰的强度是与分子中给定类型的H原子数成比例的。例如,乙醇的NMR谱中有三个信号,其强度比为3:2:1。
(1)在常温下测得的某烃C8H10(不能与溴水反应)的NMR谱上,观察到两种类型的H原子给出的信号,其强度之比为2:3,试确定该烃的结构简式为________________________;该烃在光照下生成的一氯代物在NMR谱中可产生_________种信号,强度比为__________。
(2)在常温下测定相对分子质量为128的某烃的NMR,观察到两种类型的H原子给出的信号,其强度之比为9:1,若为链烃,则该烃的结构简式为________________,其名称为_______________。观察到两种类型的H原子给出的信号,其强度之比为1:1,若为芳香烃,则该烃的结构简式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丰富多彩的颜色变化增添了化学实验的魅力,下列有关反应颜色变化的叙述正确的是( )
① 新制氯水久置后→浅黄绿色消失②Cl2通入石蕊试液中→先变红后褪色③SO2通入石蕊试液中→先变红后褪色 ④SO2通入品红溶液中→红色褪去⑤ 氨气通人酚酞溶液中→红色
A. ①②④⑤ B. ②③④⑤ C. ①②③④ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,然后打开止水夹,下列与实验事实相符的是
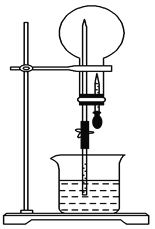
A. NH3(H2O含紫色石蕊试液),红色喷泉
B. SO2(NaOH溶液),无色喷泉
C. HCl(H2O含紫色石蕊试液),蓝色喷泉
D. NO(NaOH溶液),无色喷泉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C三种元素,已知5.75 g A单质跟盐酸完全反应,在标准状况下产生2.8L氢气和 0.25 mol ACln;B的气态氢化物的分子式为 H2B,其相对分子质量与B的最高价氧化物的水化物相对分子质量之比为1: 2.88,B原子核内质子数与中子数相等;C和B可形成液态化合物 CB2,并能溶解B的单质。试回答下列问题:
(1)A、B、C的名称分别是______、______、________;
(2) A离子的结构示意图为_______; B在周期表中的位置为_______;CB2的分子式为_______。
(3)A与B形成的化合物的化学式为_________
(4)B的最高价氧化物的水化物的化学式为_________,
(5)写出B的气态氢化物与B的低价氧化物反应生成淡黄色固体的化学方程式:__________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com