
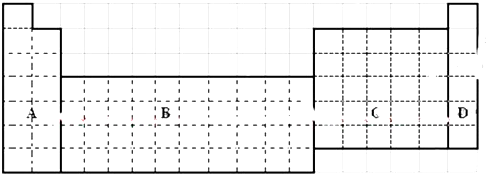
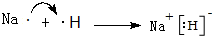 .
. 分析 (1)过渡元素均为金属元素;
(2)硬度最大的是单质是金刚石,密度最小的金属是锂,通常状况呈液态的非金属单质是溴,地壳中含量最多的非金属元素是氧;
(3)金属性越强,与水反应越剧烈;非金属性越强,元素的气态氢化物越稳定;元素的最高价氧化物所对应的酸其酸性最强的物质是高氯酸;原子半径最大的金属与原子半径最小的非金属形成的化合物是NaH,由钠离子与氢负离子构成.
解答 解:(1)s区含有H元素,p区含有金属元素与非金属元素,过渡元素均为金属元素,为图中B区域,
故答案为:b;
(2)硬度最大的是单质是金刚石,密度最小的金属是锂,通常状况呈液态的非金属单质是溴,地壳中含量最多的非金属元素是氧,
故答案为:金刚石;锂;溴;氧;
(3)同周期自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强.同主族自上而下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱,短周期中Na的金属性最强,与水反应最剧烈;非金属性越强,元素的气态氢化物越稳定,元素的最高价氧化物的酸性越强,F元素非金属性最强,故HF最稳定,F元素没有最高价含氧酸,最高价含氧酸最强为HClO4,原子半径最大的金属与原子半径最小的非金属形成的化合物是NaH,由钠离子与氢负离子构成,用电子式表示其形成过程为: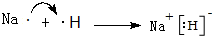 ,
,
故答案为:Na;HF;HClO4;NaH;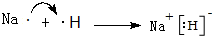 .
.
点评 本题考查元素周期表的结构和元素周期律的应用,熟练掌握元素周期表结构,理解元素周期律,掌握用电子式表示化学键或物质的形成过程.


科目:高中化学 来源: 题型:选择题
| A. | 从溴水中提取单质溴时,不能用无水乙醇代替CCl4 | |
| B. | 可用新制的Cu(OH)2悬浊液检验牙膏中存在的甘油 | |
| C. | 用纸层析法分离Cu2+和Fe3+,滤纸上端呈棕黄色,说明Fe3+在固定相中分配的更多 | |
| D. | 纸层析实验中,不能将滤纸上的试样点浸入展开剂中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极为Cu,负极为Fe,电解质为FeCl3溶液 | |
| B. | 负极为Fe,正极为C,电解质为Fe(NO3)2溶液 | |
| C. | 正极为Ag,负极为Fe,电解质为Fe2(SO4)3溶液 | |
| D. | 负极为Fe,正极为Pt,电解质为Fe2(SO4 )3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| J | ||||
| R |
 ;元素T基态原子的价电子排布式为3s23p5.
;元素T基态原子的价电子排布式为3s23p5.| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物总物质的量 |
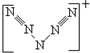 ,其中可能含有4个σ键,4个π键,4对孤电子对.
,其中可能含有4个σ键,4个π键,4对孤电子对.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
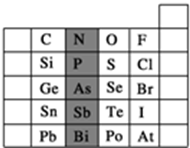 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 A、B、C、D是中学化学常见的四种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).
A、B、C、D是中学化学常见的四种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).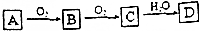
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1molC20H42中含有的共价键数目为60nA | |
| B. | 1molCl2通过足量的NaOH溶液中充分反应转移的电子数为nA | |
| C. | a g 某气体含分子数为b,c g 该气体在标况下的体积为22.4bc/(a nA)升 | |
| D. | 2.24L(标况)辛烷在32 g 氧气中充分燃烧,生成CO2的分子数为0.8nA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 和
和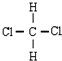
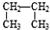 和
和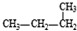
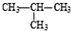
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com