
| A、c(OH-)>c(H+) |
| B、c(CH3COO-)=0.1 mol?L-1 |
| C、c(Na+)>c(CH3COO-) |
| D、c(Na+)=c(CH3COO-) |


科目:高中化学 来源: 题型:
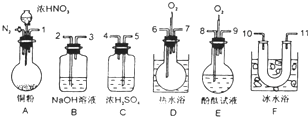
查看答案和解析>>
科目:高中化学 来源: 题型:
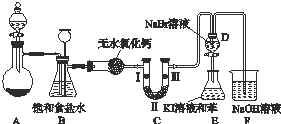 高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用.如图K103是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).
高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用.如图K103是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).| a | b | c | |
| Ⅰ | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨基酸的结构中都含有氨基和羧基 |
| B、人体内氨基酸代谢的最终产物是二氧化碳和尿素 |
| C、人体内所有氨基酸都可以相互转化 |
| D、两个氨基酸通过脱水缩合形成二肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2能与CO2反应,可用作呼吸面具的供氧剂 |
| B、Al2O3熔点高,可用于制作耐高温仪器 |
| C、明矾能水解生成Al(OH)3胶体,可用作净水剂 |
| D、Cu有良好的导电性,可用于制备光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com