
【题目】氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
合成氨的反应中的能量变化如图所示。
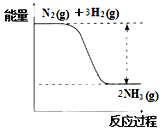
①该反应是___________反应(填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量_____(填“大于”或“小于”)生成物化学键形成放出的总能量。
②在一定条件下,将一定量的N2和H2的混合气体充入某定容密闭容器中,一段时间后,下列叙述不能说明该反应达到平衡状态的是___________(填序号)。
A.容器中混合气体的密度不随时间变化
B.单位时间内断裂3 mol H-H键的同时断裂6 mol N-H键
C.N2 、H2 、NH3的物质的量之比为1:3:2
D.容器中混合气体的平均相对分子质量不随时间变化
③一种用于驱动潜艇的液氨-液氧燃料电池原理示意如图:
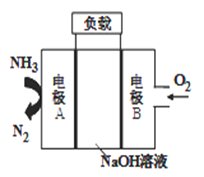
电极A上发生的电极反应为:_____________________。
若电池工作一段时间后,消耗标准状况下的氧气11.2L,则该过程转移电子______mol.
【答案】 放热 小于 AC 2NH3-6e+— 6OH—=N2 + 6H2O 2
【解析】①反应物的总能量高于生成物总能量,该反应是放热反应,其原因是反应物化学键断裂吸收的总能量小于生成物化学键形成放出的总能量。②A.根据质量守恒定律判断容器内气体的质量保持不变,容器的容积恒定,容器内混合气体的密度为恒量,容器中混合气体的密度不随时间变化不能说明反应达到平衡状态,A正确;B.断裂3 mol H-H键的同时断裂6 mol N-H键,二者分别为正反应速率和逆反应速率,能说明反应达到平衡状态,B错误;C.N2、H2、NH3的物质的量之比为1:3:2,反应不一定达到平衡状态,C正确;D.该反应正向为气体物质的量减小的反应,混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以容器中混合气体的平均相对分子质量不随时间变化说明反应达到平衡状态,D错误,答案选AC。③A电极氨气失去电子转化为氮气,电极反应式为 2NH3-6e-+ 6OH-=N2 + 6H2O;11.2L氧气是0.5mol,根据O2+ 2H2O+ 4e-=4OH-可知转移电子0.5mol×4=2mol。


科目:高中化学 来源: 题型:
【题目】前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期且相邻的元素,B基态原子2p轨道中有三个自旋方向完全相同的电子;C基态原子核外电子占有9个轨道,且只有1个未成对电子;D、E、F是位于同一周期的金属元素, D、E基态原子的价电子层中未成对电子数分别为4、2,且原子序数相差2;F是ds区元素,F基态原子的价电子层中只有1个未成对电子。
回答下列问题:
(1)E元素在周期表中的位置是____________,E的价层电子排布图为________________。E单质能导电的原因是_______________。
(2)A、B、D三种元素形成配合物D3[D(AB)6]2,该配合物的中心离子是___,1 个AB-离子中含有_____个 π键。
(3)A元素最高价氧化物分子中A原子的杂化轨道类型是______,BC3分子的立体构型是_____________。
(4)新制的F(OH)2能够溶解于浓NaOH溶液中形成一种配离子,反应的离子方程式是__。
(5)E、F元素的第二电离能分别是:IE=1753kJ/mol、IF=1958kJ/mol, IF>IE的原因是___。
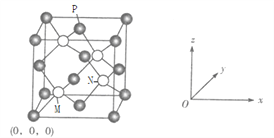
(6)C、F元素形成的一种化合物晶胞如下图,F位于面心和顶点,其晶胞参数为a pm。
①已知M点的坐标为![]() ,则N点的坐标为______,P点的坐标为_______。
,则N点的坐标为______,P点的坐标为_______。
若阿伏加德罗常数用NA表示,则该晶体的密度是_____________g/cm3(只要求列算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在极性分子中,正电荷重心同负电荷重心间的距离称偶极长,通常用d表示。极性分子的极性强弱同偶极长和正(或负)电荷重心的电量(q)有关,一般用偶极距(μ)来衡量。分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=d·q。试回答以下问题:
(1)HCl、CS2、H2S、SO2四种分子中μ=0的是____。
(2)对硝基氯苯、邻硝基氯苯、间硝基氯苯,三种分子的偶极矩由大到小的排列顺序是________。
(3)实验测得:μ(PF3)=1.03德拜;μ(BCl3)=0。由此可知,PF3分子是____构型,BCl3分子是____构型。
(4)冶癌药Pt(NH3)2Cl2具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个角上。已知该化合物有两种异构体。棕黄色者μ>0,淡黄色者μ=0。试画出两种异形体的构型图。
构型图:淡黄色____________________,棕黄色____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. Fe(SCN)3溶液中存在Fe3++3SCN-![]() Fe(SCN)3,向此溶液中加入固体KSCN后颜色变深
Fe(SCN)3,向此溶液中加入固体KSCN后颜色变深
B. 用通过盛饱和食盐水的洗气瓶来除去氯气中的少量HCl气体杂质
C. 反应CO(g)+NO2(g)![]() CO2(g)+NO(g)(正反应为放热反应)。达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应)。达平衡后,升高温度体系颜色变深
D. 合成氨:N2(g)+3H2(g)![]() 2NH3(g) △H<0在高温、高压和催化剂条件下进行
2NH3(g) △H<0在高温、高压和催化剂条件下进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(含有Cr2O3,FeO、Al2O3、SiO2等成分)为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O),其主要工艺流程如下:
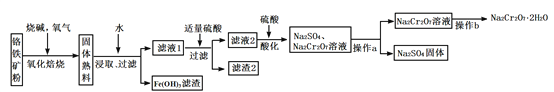
提示:熟料中含有Na2CrO4、NaFeO2等成分。
回答下列问题:
(1)将铬铁矿粉碎的目的是_____________________________ 。
(2)氧化焙烧时,生成Na2CrO4的化学方程式是__________。
(3)滤渣2中除Al(OH)3外还有__________(填化学式)。
(4)加入硫酸酸化的目的是__________________________。
(5)根据下图,请将操作a补充完整:________________,洗涤,干燥。
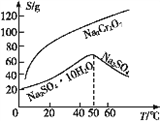
(6)控制105~110℃,向较浓的Na2Cr2O7溶液中加入KCl固体发生复分解反应,立即析出K2Cr2O7晶体。能生成K2Cr2O7晶体的原因是_____________。
(7)向Na2Cr2O7酸性溶液中加入过量FeSO4溶液,生成Cr3+和 Fe3+,再加入过量的强碱溶液生成铁铬氧体沉淀(CrxFe3-xO4)。加入过量强碱生成铁铬氧体沉淀的离子方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中不宜用物理性质区别的是( )
A. Na2CO3 和 CaCO3 固体 B. 酒精和汽油
C. 氯化铵和硝酸铵晶体 D. 碘和高锰酸钾固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列鉴别浓硫酸和稀硫酸的操作与结论有误的是( )
操作 | 结论 | |
A | 分别加入金属铝片 | 产生刺激性气味者为浓硫酸 |
B | 分别加入到盛水的试管中 | 剧烈放热者为浓硫酸 |
C | 取等体积样品,称量质量 | 质量大者为浓硫酸 |
D | 分别滴在火柴梗上 | 变黑者为浓硫酸 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com