
| A. | 1mL pH=2的醋酸溶液加水稀释到10mL,pH变为3 | |
| B. | 常温下,Na2CO3溶液中加水稀释时,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$增大 | |
| C. | 向氯水中加入少量NaOH溶液,一定有c(Na+)=c(Cl-)+c(ClO-) | |
| D. | NH4Cl溶液稀释过程中.c(NH4+)与c(NH3•H2O)之和始终保持不变 |
分析 A.醋酸是弱电解质加水稀释促进电离;
B.Na2CO3溶液中存在水解平衡:CO32-+H2O?HCO3-+OH-,加水平衡正移;
C.根据电荷守恒分析;
D.NH4Cl溶液稀释过程中浓度减小.
解答 解:A.醋酸是弱电解质加水稀释促进电离,溶液中氢离子的物质的量增大,所以1mL pH=2的醋酸溶液加水稀释到10mL,pH<3,故A错误;
B.Na2CO3溶液中存在水解平衡:CO32-+H2O?HCO3-+OH-,加水平衡正移,HCO3-的物质的量增大,CO32-的物质的量减小,则$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$增大,故B正确;
C.向氯水中加入少量NaOH溶液,溶液中存在电荷守恒:c(Na+)+c(H+)=c(Cl-)+c(ClO-)+c(OH-),由于溶液显酸性,c(H+)>c(OH-),则c(Na+)<c(Cl-)+c(ClO-),故C错误;
D.NH4Cl溶液稀释过程中浓度减小,则c(NH4+)与c(NH3•H2O)之和逐渐减小,故D错误.
故选B.
点评 本题考查了弱电解质的电离平衡和盐的水解平衡的应用,难度不大,化学平衡移动原理同样适合水解平衡的移动,要多迁移,多联系.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 透明溶液中:K+、Cu2+、SO42-、Cl- | |
| B. | KI水溶液中:K+、NO3-、SO42-、H+ | |
| C. | 使紫色石蕊试液变蓝色的溶液:K+、Na+、HS-、Cl- | |
| D. | 水电离出的c(H+)=1×10-14mol•L-1的溶液:K+、NH4+、AlO2-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应热指的是反应过程中放出的热量 | |
| B. | 原电池的负极发生氧化反应 | |
| C. | 伴随能量变化的不一定是化学变化 | |
| D. | 电解池的阳极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、油脂和蛋白质都是高分子化合物 | |
| B. | 乙酸乙酯和植物油水解均可生成乙醇 | |
| C. | “地沟油”的主要成分是油脂,其类别与煤油不同 | |
| D. | 煤中含有煤焦油及多种化工原料,可通过煤的干馏获得 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
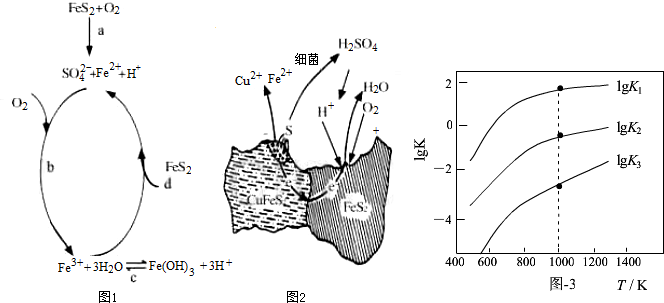
| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 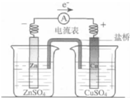 图中总反应为Zn+CuSO4═Cu+ZnSO4 | |
| B. | 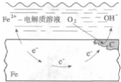 图中正极反应为2H2O+O 2+4e-═4OH- | |
| C. | 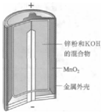 图中负极反应为Zn+2OH--2e-═Zn(OH)2 | |
| D. |  图中向Fe电极区滴入2滴铁氰化钾溶液产生蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁及其化合物在国民经济的发展中起着重要作用.
铁及其化合物在国民经济的发展中起着重要作用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com