
【题目】实验室用卤块(主要成分为MgCl2·6H2O,含有MgSO4.FeCl2等杂质)制备少量Mg(ClO3)2·6H2O的流程如下:
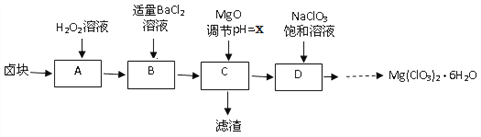

已知:①四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
②室温时一些物质的Ksp如下表:
化学式 | Fe(OH)2 | Fe(OH)3 | Mg(OH)2 |
Ksp | 8.0×10-16 | 8.0×10-38 | 1.8x10-11 |
③Mg(ClO3)2有较强的氧化性,其还原产物是Cl-.
(1)H2O2的电子式为_________
(2)滤渣的成分是____________(填化学式);
(3)经测定,D中铁离子的浓度为1×10-5 mol/L,则x为______
(4)D中所发生的化学反应方程式为_____,框图中由D→......→制Mg(ClO3)2·6H2O晶体的实验步骤依次为:①加热蒸发;②_______(请补充);③冷却结晶;④过滤洗涤。
(5)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL试液于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol/L K2Cr2O7溶液滴定剩余的Fe2+至终点。
步骤4:将步骤2、3重复两次
①步骤3中发生反应的离子方程式____________
②步骤3中若滴定前不用标准液润洗滴定管,将会导致最终结果_____(填“偏大”. “偏小”或“不变”)。
③若平均消耗K2Cr2O7溶液15.00 mL,则产品中Mg(ClO3)2·6H2O(其M=299g/mol)的质量分数为___________
【答案】 ![]() Fe(OH)3、BaSO4 3.3 2NaClO3+MgCl2=2NaCl↓+ Mg(ClO3)2 趁热过滤 6Fe2+Cr2O72-+14H+=6Fe3++2Cr3++7H2O 偏小 78.3%
Fe(OH)3、BaSO4 3.3 2NaClO3+MgCl2=2NaCl↓+ Mg(ClO3)2 趁热过滤 6Fe2+Cr2O72-+14H+=6Fe3++2Cr3++7H2O 偏小 78.3%
【解析】(1)H2O2属于共价化合物,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)卤块(主要成分为MgCl2·6H2O,含有MgSO4.FeCl2等杂质)中的亚铁离子被双氧水氧化生成铁离子,加入适量的氯化钡溶液可以使硫酸根离子沉淀,加入氧化镁调节溶液的pH,根据氢氧化物的溶度积常数,可知,可使铁离子沉淀,因此滤渣中含有Fe(OH)3、BaSO4,故答案为:Fe(OH)3、BaSO4;
(3)经测定,D中铁离子的浓度为1×10-5 mol/L,c(OH-)=![]() =2×10-11 mol/L ,则c(H+)=5×10-3 mol/L ,pH=3.3,故答案为:3.3;
=2×10-11 mol/L ,则c(H+)=5×10-3 mol/L ,pH=3.3,故答案为:3.3;
(4)根据溶解度曲线,D中NaClO3与MgCl2反应生成Mg(ClO3)2和氯化钠沉淀,反应的化学反应方程式为2NaClO3+MgCl2=2NaCl↓+ Mg(ClO3)2,Mg(ClO3)2的溶解度随温度的变化较大,由Mg(ClO3)2溶液制Mg(ClO3)2·6H2O晶体的实验步骤依次为:①加热蒸发;②趁热过滤;③冷却结晶;④过滤洗涤,故答案为:2NaClO3+MgCl2=2NaCl↓+ Mg(ClO3)2;趁热过滤;
(5)①氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价,化学方程式为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,Cr2O72-能将Fe2+氧化成Fe3+,反应的离子方程式为Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O,故答案为:Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O;
②步骤3中若滴定前不用标准液润洗滴定管,将导致消耗的标准液的体积偏大,测得剩余的亚铁离子的含量偏高,根据ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,反应消耗的亚铁离子偏少,则ClO3-含量偏少,结果偏小,故答案为:偏小;
③根据化学方程式:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O以及Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:ClO3-~6Fe2+,Cr2O72-~6Fe2+,用0.100molL-1 K2Cr2O7溶液滴定至终点过程可以得出剩余的亚铁离子的物质的量为:0.100molL-1×0.015L×6=0.009mol,和氯酸根离子反应的亚铁离子的物质的量为:20×10-3L×1.000molL-1-0.009mol=0.011mol,氯酸根离子的物质的量为:![]() ×0.011mol,产品中Mg(ClO3)26H2O的质量分数:(
×0.011mol,产品中Mg(ClO3)26H2O的质量分数:(![]() ×
×![]() ×0.011×299g/mol)×10×
×0.011×299g/mol)×10×![]() ×100%=78.3%,故答案为:78.3%。
×100%=78.3%,故答案为:78.3%。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】中学常见的某反应化学方程式为X +Y→M+N +H2O(未配平,反应条件已略去),下列叙述错误的是
A. 若X、Y的物质的量之比为1:4,且N是黄绿色气体,则该反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B. 若M、N为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪色,橙色褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-
C. 若X是铁,Y是稀硝酸(过量),则X与Y反应的离子方程式为Fe+4H++NO3- = Fe3+ +NO↑+2H2O
D. 当N为氯碱工业的主要原料,M是造成温室效应的主要气体,则上述反应的离子方程式一定为:CO32-+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 分子式为C4H8O2的有机物共有5种
B. 蛋白质在酶等催化剂作用下水解可得到氨基酸
C. 乙烷、氯乙烷、二氯乙烷互为同系物
D. 植物油中不可能含有碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于“摩尔”的理解正确的是( )
A. 10mol氧约含有6.02×1024个氧分子 B. NA 约等于6.02×1023
C. 摩尔是国际科学界广泛使用的一种物理量 D. 摩尔是物质的量的单位,简称摩,符号为mol
查看答案和解析>>
科目:高中化学 来源: 题型:
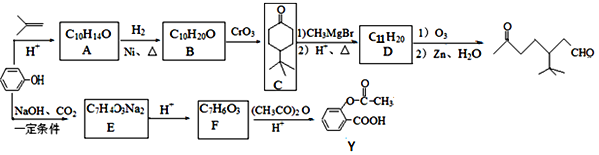
【题目】苯酚是一种重要的化工原料,利用苯酚可以合成有机物中间体X和药物Y,合成路线如下图所示:
已知: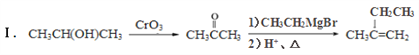

(1)下列说法正确的是________________(填序号);
A.苯酚生成化合物A的反应为取代反应
B.化合物B可发生的反应类型有取代、加成、消去、氧化反应等
C.化合物C的1H—NMR谱显示分子中有3种不同化学环境的氢原子,峰面积之比为4:4:9
D.化合物A生成化合物B为还原反应
(2)写出化合物A生成化合物B的化学方程式:__________________;
(3)写出化合物F中的官能团名称_____________________;
(4)写出化合物A同时符合下列条件的其中1个同分异构体的结构简式:____________。
①苯环上有3个取代基; ②能与FeCl3溶液发生显色反应;
③1molA与浓溴水发生取代反应时能消耗3molBr2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】⑴下列有机实验操作或叙述,正确的是________________(填写代号)
A、用新制氢氧化铜悬浊液检验糖尿病患者现象是有黑色沉淀生成。
B、乙酸乙酯中少量乙酸可用饱和Na2CO3溶液除去
C、蔗糖水解时应用浓H2SO4作催化剂
D、在鸡蛋白溶液中滴入浓HNO3,加热会产生黄色物质
E、在植物油中滴入溴水,溴水褪色
F、用盐析法分离油脂皂化反应的产物
⑵实验室制乙烯:
①反应的方程式:_____________________________________
②浓H2SO4的作用:___________________________________
③发生装置中的温度计应插在:_________________________________
④实验中要使温度迅速升到170℃的原因是:__________________________
⑤反应时混合液逐渐变黑,是乙醇发生变化产生的气体有明显的刺激性气味,
所以,制备的乙烯中混有______________气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是分离混合物时常用的仪器,回答下列问题:
(1)写出仪器C、E的名称分别是_________________、_____________
(2)分离以下混合物应该主要选用上述什么仪器?(填字母符号)
①NaCl固体和泥沙:_____________;②花生油和水:____________
(3)若向C装置中加入碘水和足量CCl4,充分振荡后静置,观察到现象是:C内液体分两层,上层液体________色,下层液体______________色。
(4)碘单质和溴单质有相类似的性质,都可以用有机溶剂萃取水溶液中的单质,若利用C仪器提取溴水中的溴单质,下列有机溶剂中不能选用的是:_____________
A.汽油 B.CCl4 C.酒精 D.醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室需要0.1 mol·L1NaOH溶液500 mL。根据溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________________。

(2)配制时,其正确的操作顺序是__________(用字母表示,每个操作只用一次)。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(3)关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;
④使用之前要检查是否漏水。这些叙述中正确的是__________(填字母)。
A.①②③④ B.②③ C.①②④ D.②③④
(4)根据计算用托盘天平称取的NaOH固体质量为______g。
Ⅱ.配制1 mol/L的稀硫酸溶液500 mL。回答下列问题。
(5)需要质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为_________mL(计算结果保留一位小数)。如果实验室有25 mL、50 mL、10 0mL量筒,应选用________mL规格的量筒最好。
(6)下面操作造成所配稀硫酸溶液浓度偏高的是______(填字母)。
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com