
| A、增大反应物浓度 |
| B、增大压强(减小体积) |
| C、降温 |
| D、加催化剂 |


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
A、 |
B、 |
C、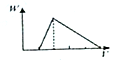 |
D、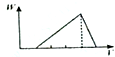 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述三个反应都有单质生成,所以都是置换反应 |
| B、反应③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol |
| C、反应②中还原剂与氧化剂的物质的量之比为6:1 |
| D、氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B、由“C(石墨)═C(金刚石)△H=1.9 kJ?mol”可知,金刚石比石墨稳定 |
| C、在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为: 2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol |
| D、在稀溶液中:H++OH-═H2O△H=-57.3 kJ?mol,若将含1mol H2SO4与含2mol NaOH的溶液混合,放出的热量等于114.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向蛋白质溶液里加(NH4)2SO4溶液可提纯蛋白质 |
| B、在豆浆中加入少量的石膏,能使豆浆凝结为豆腐 |
| C、温度越高,酶对某些化学反应的催化效率越高 |
| D、当人误食重金属盐类时,可以喝大量的牛奶、蛋清解毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④ | B、①③ | C、②③ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10:3 | B、5:3 |
| C、1:4 | D、1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 二氧化碳 | 碳酸钠 | 转移的电子 | |
| ① | 22.4L | 1mol | |
| ② | 1mol | 1mol | |
| ③ | 106g | 1mol | |
| ④ | 106g | 2mol |
| A、①③ | B、②③ | C、②④ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等于10 s |
| B、等于12 s |
| C、大于12 s |
| D、小于12 s |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com