
在一密闭容器中,加入
2 mol X和1 mol Y,发生如下反应2X(g)+Y(g)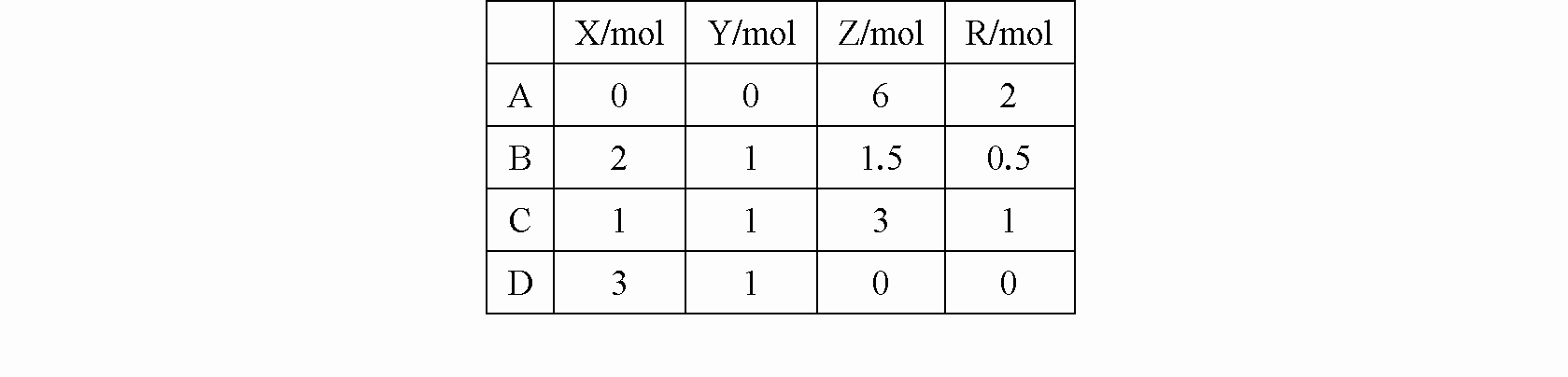
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
 钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉冶炼,常用赤铁矿、焦炭、空气和熔剂(石灰石)作原料.已知赤铁矿被还原剂还原时是逐级进行的,还原时温度及CO、CO2平衡混合气体中CO的体积分数的关系如图:
钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉冶炼,常用赤铁矿、焦炭、空气和熔剂(石灰石)作原料.已知赤铁矿被还原剂还原时是逐级进行的,还原时温度及CO、CO2平衡混合气体中CO的体积分数的关系如图:| 反应序号 | 化学反应 | 反应热 |
| ① | Fe2O3(s)+3CO(g)=2Fe(s)+3CO 2(g) | △H1=-26.7kJ?mol-1 |
| ② | 3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) | △H2=-50.8kJ?mol-1 |
| ③ | Fe3O4(s)+CO(g)=3FeO(s)+CO2 (g) | △H3=-36.5kJ?mol-1 |
| ④ | FeO(s)+CO(g)=Fe(s)+CO2(g) | △H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(CO2) |
| c(CO) |
| c(CO2) |
| c(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2011-2012年甘肃天水一中高一下学期第一学段考试理科化学试卷(解析版) 题型:选择题
在一密闭容器中,加入物质A和B后发生反应aA(S)+bB(g) cC(g),此反应是放热反应。关于化学反应速率的叙述正确的是 ( )
cC(g),此反应是放热反应。关于化学反应速率的叙述正确的是 ( )
A. 升高温度时,正反应速率加快,逆反应速率减慢
B. 增加少量的A物质,正反应的化学反应速率加快
C. 增大压强,正反应速率加快,逆反应速率也加快
D. 达到平衡时消耗B的物质的量一定等于消耗C的物质的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com