
| A. | 向AlCl3溶液中滴加过量氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 向NaNO2溶液中滴加酸性KMnO4溶液:5NO2-+2MnO4-+3H2O═5NO3-+2Mn2++6OH- | |
| C. | 醋酸除去水垢中的CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 向偏铝酸钠溶液中通入过量的CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
分析 A.一水合氨在离子反应中保留化学式;
B.酸性溶液中不能生成氢氧根离子;
C.醋酸在离子反应中保留化学式;
D.反应生成氢氧化铝和碳酸氢钠.
解答 解:A.向AlCl3溶液中滴加过量氨水的离子反应为Al3++3NH3.H2O═Al(OH)3↓+3NH4+,故A错误;
B.向NaNO2溶液中滴加酸性KMnO4溶液的离子反应为5NO2-+2MnO4-+6H+═5NO3-+2Mn2++3H2O,故B错误;
C.醋酸除去水垢中的CaCO3的离子反应为CaCO3+2CH3COOH═2CH3COO-+Ca2++H2O+CO2↑,故C错误;
D.向偏铝酸钠溶液中通入过量的CO2的离子反应为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁溶于氢碘酸中$Fe{(OH)_3}+3{H^+}=F{e^{3+}}+3{H_2}O$ | |
| B. | 次氯酸钙溶液中通入过量的二氧化碳Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO | |
| C. | 向100mL 0.1moL/L的溴化亚铁溶液中通入0.015 mol的氯气$2F{e^{2+}}+4B{r^-}+3C{l_2}=2F{e^{3+}}+2B{r_2}+6C{l^-}$ | |
| D. | 向明矾溶液逐滴加入氢氧化钡溶液至铝离子刚好完全沉淀$A{l^{3+}}+S{O_4}^{2-}+B{a^{2+}}+3O{H^-}=BaS{O_4}↓+Al{(OH)_3}↓$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (3)(4)(5) | B. | (4)(5)(7) | C. | (4)(7) | D. | (3)(4)(5)(7) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 L 1.0 mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 23 g Na与足量H2O反应完全后可生成NA个H2分子 | |
| C. | 标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5NA | |
| D. | 常温常压下,46 g的NO2与N2O4混合物含有的原子数为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
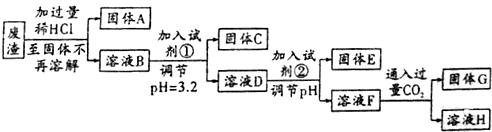
| 离子 | 以氢氧化物形式完全沉淀时所需pH | 氢氧化物沉淀完全溶解时所需pH |
| Fe3+ | 3.2 | |
| A13+ | 5.3 | 11.9 |
| Mg2+ | 12.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe2+、I-、NO3- | B. | Al3+、AlO2-、SO42-、Cl- | ||
| C. | K+、Ag+、Ca2+、NO3- | D. | NH4+、Na+、OH-、MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2晶体结构中,每个Si原子与2个O原子直接相连 | |
| B. | 通常状况下,60gSiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数) | |
| C. | 12g金刚石含4molC-C键 | |
| D. | 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 实验探究是学习化学的一个重要方法,某实验小组的同学利用下列装置完成一些常见气体制备以及相关物质性质探究(夹持装置及连接橡胶管已省略,其中装置E有多个供使用).
实验探究是学习化学的一个重要方法,某实验小组的同学利用下列装置完成一些常见气体制备以及相关物质性质探究(夹持装置及连接橡胶管已省略,其中装置E有多个供使用).| 液体试剂 | 固体药品 |
| 稀硫酸、稀盐酸、稀硝酸、NaOH溶液、浓氨水、5%H2O2溶液、浓盐酸、饱和食盐水 | CaCO3、CaO、MnO2、KMnO4、 碱石灰、Cu、Zn、Na2S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com