
【题目】海水中溴含量约为65mg·L-1,从海水中提取溴的工业流程如下:
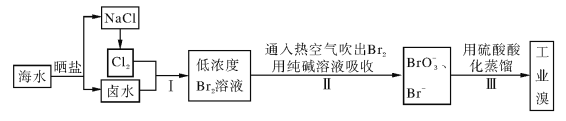
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是____。
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的________。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)以上流程Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:_____
![]() Br2+
Br2+![]() CO32-===
CO32-===![]() BrO3-+
BrO3-+![]() Br-+
Br-+![]() CO2↑
CO2↑
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式:__________。
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是_____。
A.乙醇 B.四氯化碳 C.烧碱溶液 D.苯
【答案】(1)富集(或浓缩)溴元素;(2)C;
(3)3 3 1 5 3
(4)SO2+Br2+2H2O===2HBr+H2SO4;(5)BD
【解析】
试题(1) 以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是富集(或浓缩)溴元素。(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的易挥发的性质。
(3) 根据电荷守恒、电子守恒平衡:3Br2+3CO===1BrO+5Br-+3CO2↑
(4)溴与二氧化硫水溶液反应的化学方程式:SO2+Br2+2H2O===2HBr+H2SO4。
(5)实验室分离溴还可以用溶剂萃取法,溴易溶于有机溶剂,可用四氯化碳、苯[来作溴的萃取剂;乙醇与水互溶,不能用乙醇作溴的萃取剂。


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作规范且能达到目的的是
目的 | 操作 | |
A. | 取20.00 mL盐酸 | 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形瓶 |
B. | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
C. | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
D. | 配制浓度为0.010 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明同学设计了如图所示装置来探究铜跟浓硫酸的反应。
先关闭活塞a,加热至烧瓶中不再有气泡产生时,反应停止,此时烧瓶中铜片仍有剩余。再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢消失。
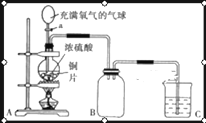
(1)请写出上述过程A装置中所涉及的化学反应方程式。
________________________
_________________________
(2)实验中加热至烧瓶中不再有气泡产生时,反应停止,此时烧瓶中铜片为什么有剩余?请简述其原因是:___________。
(3)老师认为实验中B装置设计有误,请你帮助小明进行修改:___________。
(4)B中所收集到的气体既具有氧化性又具有还原性,请写出该气体与O2反应的化学方程式:______。
(5)装置C中应盛放____溶液,其作用是:____,所发生的离子方程式为:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“价——类”二维图是学习元素化合物知识的好方法,依据图中氮元素及其化合物的转化关系,回答问题:
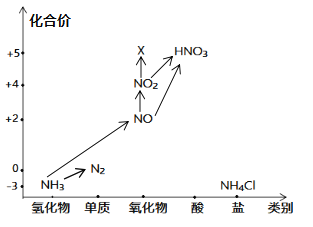
(1)图中,X的化学式为_____,从N元素的化合价看,X具有_____性(“氧化”、“还原”)。
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为______。
②下列试剂不能用于干燥NH3的是______(填字母)。
A.浓硫酸 B.碱石灰 C.NaOH固体
③请写出NH3→NO的化学方程式_____________ 。
④工业生产中利用氨水吸收SO2和NO2,原理如下图所示:
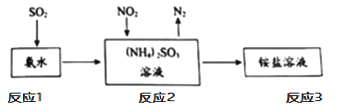
请写出反应2中NO2被吸收过程的化学反应程式是_____。
(3)SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。SCR(选择性催化还原)工作原理:
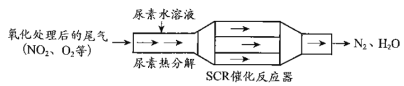
①已知尿素[CO(NH2)2]水溶液热分解为NH3和CO2,请写出SCR催化反应器中NH3还原NO2的化学方程式:_________。
②尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60g·mol 1)含量的方法如下:取ag尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1mLc1mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2mLc2mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成S、C、Si三种元素的非金属性强弱比较的实验研究。乙同学设计了如图装置来验证卤族元素的性质递变规律,A、B、C三处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
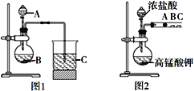
(1)如图中仪器A的名称是____。甲同学实验步骤:连接仪器、______、加药品、滴入试剂。
(2)①如图中仪器A中盛放试剂稀硫酸,烧瓶B中的盛放试剂为___溶液,C中的盛放试剂为______溶液。
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是_________。
(3)如图中A处反应的离子方程式为__________。
(4)乙同学发现如图中B处试纸变蓝,C处红纸褪色,据此____(填“能”或“不能”)得出溴的非金属性强于碘,理由是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:
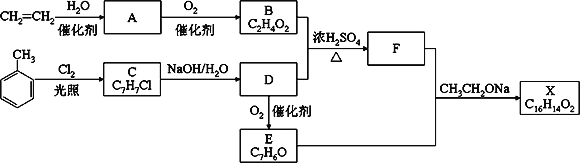
已知:RX![]() ROH;RCHO+CH3COOR’
ROH;RCHO+CH3COOR’![]() RCH=CHCOOR’ 请回答:
RCH=CHCOOR’ 请回答:
(1) A中官能团的名称是______________________。
(2) B +D→F的化学方程式________________________________________________。
(3) X的结构简式_________________。
(4) 与F互为同分异构体又满足下列条件的有_______种。
①遇到氯化铁溶液会显紫色,②会发生银镜反应 ③苯环上有三个取代基
在其它同分异构体中核磁共振氢谱有六组峰,氢原子数比符合1:2:2:2:2:1的结构为______________(写出一种即可)。
(5)根据上面合成信息及试剂,写出以乙烯为原料(无机试剂任选),写出合成CH3CH=CHCOOCH2CH3路线_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂选用的试剂或操作方法正确的是
物质 | 杂质 | 除去杂质选用的试剂或操作方法 | |
A | KNO3溶液 | KOH | 加入适量氯化铁溶液,并过滤 |
B | FeSO4溶液 | CuSO4 | 加入过量铜粉,并过滤 |
C | H2 | CO2 | 先后通过盛有氢氧化钠溶液和浓硫酸的洗气瓶 |
D | 铁粉 | 铜粉 | 加入足量稀硫酸过滤 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容的容器中进行反应:2HI![]() H2+I2(正反应为吸热反应),反应物的浓度由0.1 mol/L降到0.06 mol/L需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间为
H2+I2(正反应为吸热反应),反应物的浓度由0.1 mol/L降到0.06 mol/L需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间为
A. 等于10 s B. 等于12 s C. 大于12 s D. 小于12 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表短周期的一部分,下列关于X、Y、Z、M的说法中正确的是( )

A. ZX2形成的晶体为分子晶体
B. Y的最高正价等于其最外层电子数
C. 原子半径:M>Z>Y
D. 非金属性:Z>X>Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com