
 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:分析 (1)铁是26号元素,位于周期表中第四周期第ⅤⅢ族;
(2)分子晶体的熔沸点较低;配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,据此判断x值;根据生成物判断形成的化学键;
(3)K3[Fe(CN)6]遇Fe2+,出现特殊的蓝色沉淀,可用于检验Fe2+,根据C原子价层电子对个数确定杂化方式;一般来说非金属性越强,第一电离能越大,但是因为p轨道半充满体系具有很强的稳定性,会有特例,如N的p轨道本来就是半充满的,O的p轨道失去一个电子才是半充满的,所以O比N容易失去电子;
(4)①铜为29号元素,据此写出基态铜原子的核外电子排布式;
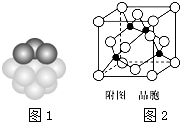
②根据晶胞结构图可知,铜为面心立方堆积,据此判断每个铜原子周围距离最近的铜原子数目;
(5)根据价电子排布式判断出X原子为Cl原子;
①利用均摊法计算得出;
②根据电负性差值判断化合物类型;
③计算出一个晶胞中微粒数,利用化合物的摩尔质量和密度计算出晶胞边长,根据晶胞的结构可知,铜原子和M原子之间的最短距离为立方体体对角线的$\frac{1}{4}$.
解答 解:(1)铁是26号元素,位于周期表中第四周期第ⅤⅢ族,
故答案为:第四周期第ⅤⅢ族;
(2)分子晶体的熔沸点较低,根据题给信息知,该物质的熔沸点较低,所以为分子晶体,配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,8+2x=18,x=5,Fe(CO)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应生成Fe,所以形成的化学键为金属键,
故答案为:分子晶体;5;金属键;
(3)K3[Fe(CN)6]遇Fe2+,出现特殊的蓝色沉淀,可用于检验Fe2+,CN-中C原子价层电子对个数=1+$\frac{1}{2}$(4+1-1×3)=2,所以采取sp杂化;一般来说非金属性越强,第一电离能大,但是因为p轨道半充满体系具有很强的稳定性.N的p轨道本来就是半充满的.O的p轨道失去一个电子才是半充满的.所以C、N、O三元素的第一电离能由大到小的顺序为N>O>C,
故答案为:Fe2+;sp杂化;N>O>C;
(4)①铜为29号元素,基态铜原子的核外电子排布式为[Ar]3d104s1 或1s22s22p63s23p63d104s1,
故答案为:[Ar]3d104s1 或1s22s22p63s23p63d104s1;
②根据晶胞结构图可知,铜为面心立方堆积,所以每个铜原子周围距离最近的铜原子位于经过该原子的立方体的面的面心上,共有12个,
故答案为:12;
(5)根据价电子排布式判断出X原子为Cl原子;
①由晶胞结构可知,Cu原子处于晶胞内部,晶胞中含有4个Cu原子,Cl原子属于顶点与面心上,晶胞中含有Cl原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故化学式为CuCl,
故答案为:CuCl;
②电负性差值大于1.7原子间易形成离子键,小于1.7原子间形成共价键,铜与X的电负性分别为1.9和3.0,差值为1.1小于1.7,形成共价键,
故答案为:共价;
③一个晶胞的摩尔质量为4×99.5g/mol,晶胞摩尔体积为$\frac{4×99.5}{ρ}$cm3,晶胞的边长为$\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$cm,根据晶胞的结构可知,铜原子和M原子之间的最短距离为立方体体对角线的$\frac{1}{4}$,而体对角线为晶胞边长的$\sqrt{3}$倍,所以铜原子和M原子之间的最短距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$cm=$\frac{\sqrt{3}}{4}$$\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$×1010pm,
故答案为=$\frac{\sqrt{3}}{4}$$\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$×1010.
点评 本题考查较为全面,涉及到电子排布式、第一电离能、杂化类型的判断、配合物以及有关晶体的计算,但解题具有较强的方法性和规律性,学习中注意总结如何书写电子排布式,如何判断分子空间构型以及有关晶体计算等方法,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液通入SO2:Ca2++2ClO-+SO2+H2O═2HClO+CaSO3↓ | |
| B. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 少量的Na2SO3溶液滴加到足量稀盐酸中:SO32-+2H+═H2O+SO2↑ | |
| D. | 硅酸钠溶液中通入过量二氧化碳:SiO32-+CO2+H20═H2SiO3(胶体)+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
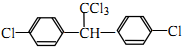 .下列有关DDT的说法正确的是( )
.下列有关DDT的说法正确的是( )| A. | 它属于芳香烃 | B. | 分子中最多有23个原子共平面 | ||
| C. | 分子式为C14H9Cl5 | D. | 能发生水解反应和消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水时,当溶液pH由7变为13,电路中转移的电子数为0.1NA | |
| B. | 标准状况下,35.5 g 氯气与足量红热的铁充分反应得到的电子数一定为NA | |
| C. | 标准状况下,2.24 L HF中含有的原子数为0.2NA | |
| D. | 在密闭容器中加入0.5 moL N2和1.5 moL H2,充分反应后容器中的N-H键数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
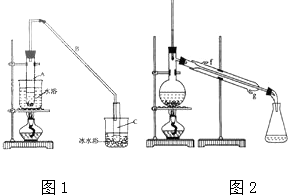 某化学小组以环己醇制备环己烯(如图1),
某化学小组以环己醇制备环己烯(如图1), $→_{85℃}^{浓H_{2}SO_{4}}$
$→_{85℃}^{浓H_{2}SO_{4}}$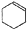 +H2O
+H2O| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
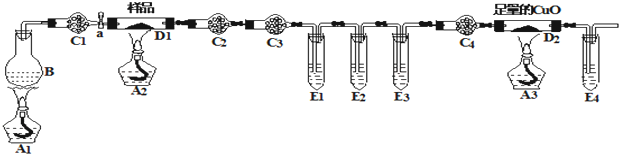
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加入的物质 | 结论 | |
| A | 100mL H2O | 由水电离出的c(H+)•c(OH-)不变 |
| B | 0.01molK2O | 溶液中$\frac{c(HC{{O}_{3}}^{-})}{c(O{H}^{-})}$ 增大 |
| C | 50mL 1mol/LH2SO4 | 反应结束后,c(Na+)=c(SO42-) |
| D | 0.1molKHSO4固体 | 反应结束后,溶液pH=7 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应是放热还是吸热必须看生成物和反应物所具有的总能量的相对大小 | |
| B. | 绿色植物进行光合作用时,将太阳能转化为化学能储存起来 | |
| C. | 吸热反应都要加热才能进行 | |
| D. | 物质的化学能可以在一定条件下转化为热能、电能为人类所利用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com