
【题目】几种含硅元素的物质之间的相互转化关系如图所示:

(1)写出图示反应的几种物质的化学式:B________,C________,D________。
(2)写出下列反应的化学方程式:①B→A:______________________________;
②B→E:_____________________________________________________。
(3)写出下列溶液中反应的离子方程式:D→C___________________________
【答案】 SiO2 H2SiO3 Na2SiO3 SiO2+2C![]() Si+2CO↑ CaCO3+SiO2
Si+2CO↑ CaCO3+SiO2![]() CaSiO3+CO2↑ SiO32-+H2O+CO2===H2SiO3↓+CO32-
CaSiO3+CO2↑ SiO32-+H2O+CO2===H2SiO3↓+CO32-
【解析】(1)都是含硅元素的物质,D中通入CO2得C,C高温强热得B,就可以推断D为Na2SiO3、C为H2SiO3,B为SiO2,E为CaSiO3,依此类推:SiO2与炭混合强热得A,则A为Si,验证符合转化关系,则B为SiO2,C为H2SiO3,D为Na2SiO3;
(2)①B→A的反应方程式为:SiO2+2C![]() Si+2CO↑;
Si+2CO↑;
②B→E的反应方程式为:SiO2+CaCO3![]() CaSiO3+CO2↑。
CaSiO3+CO2↑。
(3)硅酸钠溶液中通入CO2气体,生成硅酸,此反应的离子方程式为SiO32-+H2O+CO2===H2SiO3↓+CO32-。


科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性条件下易分解,在空气中易被氧化。某化学兴趣小组通过如图装置(省略夹持装置)制备Na2S2O3。

(1)实验开始的步骤,组装好仪器,____________,按图示加入试剂,关闭K1打开K2,先向C中烧瓶加入Na2S和 Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4。
(2)C中的烧瓶发生如下反应:2Na2S+ Na2CO3+4SO2=3Na2S2O3+CO2,反应开始后,C中先有浑浊产生,后又变澄清,此浑浊物是________;为了保证Na2S2O3的产量,实验中通入C的SO2不能过量,用离子方程式表示其原因_________。
(3)该实验制得的产品中含有NaSO4杂质,为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验开始的步骤进行了改进,改进后的操作是__________。
(4)B装置可以起到安全瓶,防止倒吸的作用,另外在实验结束后拆除装置时还可以防止污染空气,具体操作方法是____________。
(5)制取Na2S2O3的另一种方法是直接将硫粉和亚硫酸钠,数混合共热制取。为探究制取硫代硫酸钠最佳条件,设计如下对比实验(每次实验时亚硫酸钠质量均为63g,反应时间为30min):
实验序号 | 溶液pH | 亚硫酸钠与水的质量比 | 反应温度 | 硫粉质量 | 亚硫酸钠转化率 |
1 | 10 | 1.5:1 | 100℃ | 18 | 80.7% |
2 | 10 | 1.1:1 | 100℃ | 18 | 94.6% |
①实验1、2的目的是探究_________对亚硫酸钠转化率的影响;
②若要完成上表中列出的各项条件对亚硫酸钠转化率的影响探究,除实验1、2外,至少还需进行____次对比实验;
③实验表明:亚硫酸钠转化率不受硫粉质量多少的影响.原因为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活、社会可持续发展密切相关。下列变化不属于化学研究范畴的是( )
A. MERS病毒疫苗的研制 B. 朝鲜的原子弹爆炸实验
C. 近期出现雾霾的原因探究 D. 马鞍山钢铁厂冶炼铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铷(Rb)的叙述不正确的是
A. 位于周期表的第五周期第IA族B. 氢氧化铷是一种强碱
C. 钠、钾、铷单质的还原性依次减弱D. 硝酸铷易溶于水且全部电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图能量变化曲线判断,下列说法正确的是
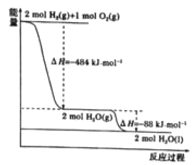
A. H2(g)+1/2O2(g)=H2O(l) △H=-242kJ·mol-1
B. 若H—H、O==O的键能分别是436 kJ·mol-1和496 kJ·mol-1,则H—O的键能是463 kJ·mol-1
C. 据图可知,氢气的燃烧热为242 kJ·mol-1
D. 10克氢气在氧气中完全燃烧,放出热量为1210kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如下图所示。R原子最外层 电子数是电子层数的2倍,Y 与Z 能形成Z2Y、Z2Y2 型离子化合物, Z 与T形成的化合物Z2T。下列推断错误的是
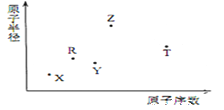
A. 形成的简单离子半径的大小顺序为T>Y>Z
B. Z2Y、Z2Y2所含有的化学键类型相同
C. 0.005mol·L-1T的最高价氧化物对应水化物的水溶液pH等于2
D. Z2T的水溶液显碱性,对水的电离有促进作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学一选修3:物质结构与性质】
卤族元素单质与许多物质反应形成多种化合物。请利用所学物质结构与性质的相关知识回答:
(1)写出基态碘原子的价电子排布式___________;
(2)卤族元素的含氧酸中酸性最强的是____(写化学式),该酸根离子的立体构型为_________。
(3)比较下列锗的卤化物的熔点和沸点,分析其变化规律及原因_________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | -49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)己知高碘酸有两种形式,化学式分别为H5IO6(![]() )和HIO4,前者为五元酸,后者为一元酸,二者酸性强弱顺序为H5IO6_____ HIO4(填“>”、“<”或“=”)。H5IO6中σ键与π键的个数比为________。
)和HIO4,前者为五元酸,后者为一元酸,二者酸性强弱顺序为H5IO6_____ HIO4(填“>”、“<”或“=”)。H5IO6中σ键与π键的个数比为________。
(5)己知氯元素与第四周期最外层只有1个电子、次外层的所有原子轨道均充满电子的元素M形成的一种化合物的立方晶胞如图所示。
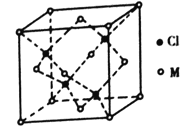
①该化合物的化学式为_______,己知晶胞参数a=0.542 nm,此晶体的密度为_____g/cm3。(写出计算式,不要求计算结果,阿伏加德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用胆矾配制1L 0.1mol/L的硫酸铜溶液,正确的做法是)
A. 将胆矾加热除去结晶水后,称取16 g溶于1L水中
B. 称取胆矾25 g溶于1L水中
C. 将25 g胆矾溶于少量水,然后将溶液稀释至1L
D. 将16 g胆矾溶于水,然后将溶液稀释至1L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com